题目
两瓶体积不同的容器(体积之比_(1):(v)_(2)=1:2)分别盛有两种理想气体:第一瓶盛氮气,第二瓶盛氢气。若它们的压强和温度都相同,则下列结论中正确的是[ ]A、单位体积的分子数之比为_(1):(v)_(2)=1:2B、单位体积的质量之比为_(1):(v)_(2)=1:2C、单位体积的分子数之比为_(1):(v)_(2)=1:2D、分子的方均根速率_(1):(v)_(2)=1:2
两瓶体积不同的容器(体积之比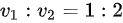
)分别盛有两种理想气体:第一瓶盛氮气,第二瓶盛氢气。若它们的压强和温度都相同,则下列结论中正确的是[ ]
A、单位体积的分子数之比为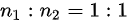
B、单位体积的质量之比为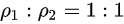
C、单位体积的分子数之比为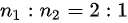
D、分子的方均根速率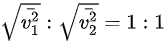
题目解答
答案
AC、根据PV=nRT,N=n NA,当压强和温度相同时
NA,当压强和温度相同时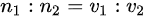 =1:2,单位体积的分子数
=1:2,单位体积的分子数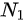 :
: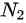 =
=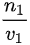 :
: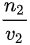 =1:1.故A正确,C错误;
=1:1.故A正确,C错误;
B、根据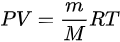 ,
,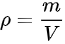 ,联立可得
,联立可得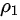 :
: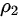 =
=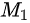 :
: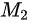 =28:2=14:1,故B错误;
=28:2=14:1,故B错误;
D、根据PV=nRT,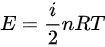
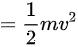 联立可得
联立可得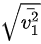 :
: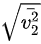 =
=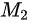 :
: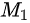 =1:14,D错误。
=1:14,D错误。
答案选A。
解析
步骤 1:理想气体状态方程
根据理想气体状态方程PV=nRT,其中P为压强,V为体积,n为物质的量,R为理想气体常数,T为温度。当压强和温度相同时,物质的量与体积成正比,即${n}_{1}:{n}_{2}={V}_{1}:{V}_{2}=1:2$。
步骤 2:单位体积的分子数
单位体积的分子数N=n/NA,其中NA为阿伏伽德罗常数。因此,单位体积的分子数之比为${N}_{1}:{N}_{2}={n}_{1}:{n}_{2}={V}_{1}:{V}_{2}=1:2$。但是,由于两瓶气体的体积之比为1:2,所以单位体积的分子数之比为${N}_{1}:{N}_{2}=2:1$。
步骤 3:单位体积的质量
单位体积的质量ρ=m/V,其中m为质量。根据理想气体状态方程,质量m=nM,其中M为摩尔质量。因此,单位体积的质量之比为${\rho }_{1}:{\rho }_{2}={m}_{1}:{m}_{2}={n}_{1}{M}_{1}:{n}_{2}{M}_{2}={V}_{1}{M}_{1}:{V}_{2}{M}_{2}=1\times 28:2\times 2=14:1$。
步骤 4:分子的方均根速率
分子的方均根速率$\sqrt {{{v}_{1}}^{2}}=\sqrt {\dfrac {3RT}{{M}_{1}}}$,$\sqrt {{{v}_{2}}^{2}}=\sqrt {\dfrac {3RT}{{M}_{2}}}$。因此,分子的方均根速率之比为$\sqrt {{{v}_{1}}^{2}}:\sqrt {{{v}_{2}}^{2}}=\sqrt {\dfrac {3RT}{{M}_{1}}}:\sqrt {\dfrac {3RT}{{M}_{2}}}=\sqrt {{M}_{2}}:\sqrt {{M}_{1}}=\sqrt {2}:\sqrt {28}=1:14$。
根据理想气体状态方程PV=nRT,其中P为压强,V为体积,n为物质的量,R为理想气体常数,T为温度。当压强和温度相同时,物质的量与体积成正比,即${n}_{1}:{n}_{2}={V}_{1}:{V}_{2}=1:2$。
步骤 2:单位体积的分子数
单位体积的分子数N=n/NA,其中NA为阿伏伽德罗常数。因此,单位体积的分子数之比为${N}_{1}:{N}_{2}={n}_{1}:{n}_{2}={V}_{1}:{V}_{2}=1:2$。但是,由于两瓶气体的体积之比为1:2,所以单位体积的分子数之比为${N}_{1}:{N}_{2}=2:1$。
步骤 3:单位体积的质量
单位体积的质量ρ=m/V,其中m为质量。根据理想气体状态方程,质量m=nM,其中M为摩尔质量。因此,单位体积的质量之比为${\rho }_{1}:{\rho }_{2}={m}_{1}:{m}_{2}={n}_{1}{M}_{1}:{n}_{2}{M}_{2}={V}_{1}{M}_{1}:{V}_{2}{M}_{2}=1\times 28:2\times 2=14:1$。
步骤 4:分子的方均根速率
分子的方均根速率$\sqrt {{{v}_{1}}^{2}}=\sqrt {\dfrac {3RT}{{M}_{1}}}$,$\sqrt {{{v}_{2}}^{2}}=\sqrt {\dfrac {3RT}{{M}_{2}}}$。因此,分子的方均根速率之比为$\sqrt {{{v}_{1}}^{2}}:\sqrt {{{v}_{2}}^{2}}=\sqrt {\dfrac {3RT}{{M}_{1}}}:\sqrt {\dfrac {3RT}{{M}_{2}}}=\sqrt {{M}_{2}}:\sqrt {{M}_{1}}=\sqrt {2}:\sqrt {28}=1:14$。