题目
14-18 如果氢原子中电子从第n轨道跃迁到第 k=2 轨道,所发出光的波长为 lambda =487m, 试确定第n-|||-轨道的半径。
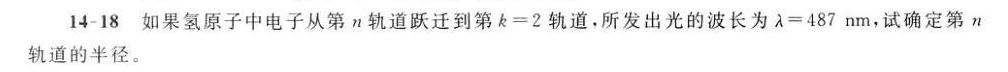
题目解答
答案
解析
步骤 1:确定波长与能量的关系
根据波长 $\lambda$ 和能量 $E$ 的关系,我们有 $E = \frac{hc}{\lambda}$,其中 $h$ 是普朗克常数,$c$ 是光速。将 $\lambda = 487 \text{ nm}$ 转换为米,即 $\lambda = 487 \times 10^{-9} \text{ m}$,代入公式计算能量 $E$。
步骤 2:确定能量与轨道的关系
根据玻尔模型,氢原子中电子从第 $n$ 轨道跃迁到第 $k=2$ 轨道时,能量差为 $E = E_n - E_2$,其中 $E_n = -\frac{13.6}{n^2} \text{ eV}$,$E_2 = -\frac{13.6}{2^2} \text{ eV}$。将能量 $E$ 转换为电子伏特(eV),并解出 $n$。
步骤 3:计算第 $n$ 轨道的半径
根据玻尔模型,第 $n$ 轨道的半径为 $r_n = n^2 a_0$,其中 $a_0$ 是玻尔半径,$a_0 = 5.29 \times 10^{-11} \text{ m}$。将 $n$ 的值代入公式计算 $r_n$。
根据波长 $\lambda$ 和能量 $E$ 的关系,我们有 $E = \frac{hc}{\lambda}$,其中 $h$ 是普朗克常数,$c$ 是光速。将 $\lambda = 487 \text{ nm}$ 转换为米,即 $\lambda = 487 \times 10^{-9} \text{ m}$,代入公式计算能量 $E$。
步骤 2:确定能量与轨道的关系
根据玻尔模型,氢原子中电子从第 $n$ 轨道跃迁到第 $k=2$ 轨道时,能量差为 $E = E_n - E_2$,其中 $E_n = -\frac{13.6}{n^2} \text{ eV}$,$E_2 = -\frac{13.6}{2^2} \text{ eV}$。将能量 $E$ 转换为电子伏特(eV),并解出 $n$。
步骤 3:计算第 $n$ 轨道的半径
根据玻尔模型,第 $n$ 轨道的半径为 $r_n = n^2 a_0$,其中 $a_0$ 是玻尔半径,$a_0 = 5.29 \times 10^{-11} \text{ m}$。将 $n$ 的值代入公式计算 $r_n$。