题目
二、填空(每空一分,共20分)●有效数字是指实际能测量到的数字,H d=5.00表示 2 位有效数字。●能更好地说明测定数据分散程度的是√A.标准偏差 B.相对偏差 C.绝对误差 D.平均偏差●下列论述中错误的是A. 单次测量结果的偏差之和等于零 B. 标准偏差是用于衡量测定结果的分散程度 C. 系统误差呈正态分布 D. 偶然误差呈正态分布 E. 2●下列情况引起偶然误差的是 F. 重量法测定SiO2时,硅胶沉淀不完全 G. 使用腐蚀了的砝码进行称量 滴定管读数最后一位估计不准 所有试剂中含有干扰组分 2●分析结果属于系统误差是下列何种情况?(10.12) 试样未充分混匀 滴定时有液滴溅出 称量时试样吸收了空气中的水分 天平零点稍有变动 ●重量分析中,沉淀溶解损失属于 过失误差 操作误差 系统误差 偶然误差 3●甲、乙二人同时分析某矿物中含硫量,每次采样3.5g,分析结果的平均值分别报告位,甲:0.042%;乙、0.04201%,则正确报告应是 甲、乙二人的报告均正确 甲的报告正确 甲、乙二人的报告均不正确 乙的报告正确 ●称量法中测定黄铁矿中硫的含量,称取样品0.385g,下列分析结果合理的是 36% √ 36.4% 36.41% 36.410% ●测量某试样,五次结果的平均值为32.30%,H d=0.13%,置信度为95%(H d=5时,H d=2.7)时的置信区间报告如下,其中合理的是(12) 32.30±0.1616162 32.30±0.162 32.30±0.1616 √ 32.30±0.16 ●碱式滴定管起泡未赶出,滴定过程中气泡消失,会导致 ●有效数字不仅表示 数量的大小,还反映出测定的 准确程度。 H=4.765为 3 位有效数字,m = 9.27g的有效数字可看作 4 位。 H=3.24的有效数字为 2 位,lgK=8.7的有效数字为 2 位。(12) ●25.5508有 6 位有效数字,若保留3位有效数字,应按 四去六入五成双 的原则修约为 25.6 。 ●对于常量组分的测定,一般要求分析结果保留 四 位有效数字,对于各种误差和偏差的计算一般要求保留 1~2 位有效数字 3●常用分析天平(万分之一)可称准至 0.1 H d。对于一般滴定分析的准确度,要求相对误差≤0.1%,用减量法称取样品时,一般至少应称取 0.2 H d,滴定时所用溶液体积至少要 20 H d(12) 2●定量分析中,系统 误差影响测定结果的准确度, 偶然 误差影响结果的精密度。 ●滴定剂含有被测组分造成 系统 误差。 ●某样品三次平行测定的结果为25.40、25.21、25.32,平均值为 25.31 ,相对平均偏差为 0.3% (12) L。 ●作为基准物质必须符合 、 、 和 。 ●滴定分析法对滴定反应的要求是 、 、 和 。 3●0.1011H dH d标准溶液对H d(H d=126.07)的滴定度为 0.006425 H d,若滴定0.1560H d草酸试样时用去该H d溶液22.60H d,则试样中H d的质量分数为 63.73 。 M(H d)=106.0)的滴定度为 0.005300H d,若滴定0.1250H dH d试样时用去该H d溶液22.50H d,则试样中H d的质量分数为 95.40%。(12) ●酸碱指示剂的理论变色点为 。当允许误差为±0.1%,强碱滴定一元弱酸时,目视直接滴定的条件是 。 ●用0.1000H dH d标准溶液滴定0.1000H dH d时,H d突跃为9.70~4.30;当用0.0100H dH d滴定0.0100H dH d时,H d突跃为 8.70~5.30 ,可选 甲基红(或中性红 作指示剂。 H突跃范围的大小主要与 Kb 有关,其次还与 c 有关。(12) ●当允许误差为±0.1%,强酸滴定一元弱碱时,目视直接滴定的条件是 。 ●H d和H d均可用来标定H d溶液,但二者相比 H d 更适合用作基准物,原因是 H d摩尔质量大,可减少称量误差。 ●标定H d溶液浓度,可选H d或H d为基准物。若H d中含有水,标定结果 偏高 ,若硼砂部分失去结晶水,标定结果 偏低 。若两者均处理得当,没有以上问题,则选 硼砂 (两者之一)作为基准物更好,其原因是 H d与两者均按化学计量比1﹕2反应,但硼砂摩尔质量大,称量误差小 。 H值的最简式为 。 H值的最简式为 。 H = pKa + lg[A-]/[HA] 。 NaH2PO4的质子平衡方程式为 [H+] + [H3PO4] = [OH-] + [HPO42-] + 2[PO43-] 。 Na2HPO4的质子平衡方程式为 。 NH4)2HPO4的质子平衡方程式(PBE)为 。 HAc+H2CO3混合溶液的质子平衡方程式(PBE)为 。 3●H d在水溶液中的质子条件是 H d(12) [H d]+[H d]+[H d]=[H d] ●用0.1000H dH d标准溶液滴定0.1000H d一元弱酸H d,化学计量点时消耗H d24.36H d,当消耗H d标准溶液12.18H d使溶液的H d值为4.21,此一元弱酸H d的H d为 4.21 。 2●0.1H d的H d(H d=1.82,H d=7.00),用同浓度H d滴定时,滴定曲线上出现 2 个H d突跃。 2●用0.1H dH d滴定同浓度的酒石酸(H d=3.04,H d=4.37),滴定曲线有 1 个H d突跃。(12) ●用0.1H dH d滴定同浓度的邻苯二甲酸(H d=2.89,H d=5.54),滴定曲线有 1 个H d突跃。 V1﹥V2,且均大于零,则溶液的组成为 H d+ H d 。 2●有一混合碱液,用H d滴至酚酞终点,消耗34.12H d,接着加入甲基橙,再用H d滴至橙色,又消耗盐酸15.66H d,则此混合碱的组成为 H d+ H d。 M浓度为干扰离子N浓度十分之一(10倍)时,欲用控制酸度法滴定M,要求TE≤ ±0.5%,△pM≈0.3,需lgc2K’ ≥5 ,则△lgK ≥6(4) 。(12) DTA滴定金属离子 e’时,需控制溶液的最高H d值应为 2.2 ,最低H d值应为 1.2 。(可参看附表附图) ●在H d配位滴定中,为了使滴定突跃增大,一般来说,H d值应较大,但也不能太大,因为同时还要考虑到待测金属离子的 水解 和 指示剂 的使用范围。 ●配位滴定法中,金属离子的配位效应计算式为 , H d的酸效应计算式为 。 2●在配位滴定中溶液的H d越小,H d的酸效应 越大 ,条件稳定常数 越小 。 DTA的酸效应是指 。 3●对于不能形成配合物或者形成的配合物不稳定的情况,需要进行配位滴定时,可采用 间接 方式。(12) 2●高锰酸钾是强氧化剂,一般在 强酸性 条件下使用;碘与硫代硫酸钠的反应应该在 中性或弱酸性 溶液中进行;而沉淀滴定法中的摩尔法只能在 中性或弱碱性(6.5-10.5)溶液中进行。(12) 244+ 3×0.059/n4 —→E426—3×0.059/n2 334+ 3×0.059/n3 →E423-3×0.059/n2+ ●酸性条件下,H d和H d的反应速度的特点是 先慢后快再慢 ,这是因为它是 自身催化 反应,H d加快了H d和H d地反应,它是 诱导体 ,该反应是 诱导反应 。 ●碘量法测铜时,由于H d沉淀吸附H d,使结果 偏低 ,所以在接近终点时,加入的作用是 将转化为释放出被吸附的离子 。 ●碘量法中常用和标准溶液,滴定应在 中性或弱酸性 条件下进行,测定中含量时,应先加入过量的 溶液,再用 标准溶液滴定,指示剂淀粉溶液应在 接近计量点 时加入。 ●间接碘量法的基本反应为 2-2→ 和 +2→2+ , 和的反应须在 中性或弱酸性 溶液中进行;若用间接碘量法测定电镀液中含量,指示剂应在 近终点 时加入;为防止的干扰,应加入 ,使生成 配离子。 ●中铜含量的测定,用 作滴定剂,指示剂是 淀粉 ,为减少对的吸附,可加入试剂 。 HSO消化,使N转化为NHHSO,并沉淀为(NH)PtCl,再灼烧为G g的Pt,则试样中N%的计算式为 。 3●聚集速率和定向速率的相对大小直接影响沉淀的类型,其中聚集速率主要由 沉淀条件(或相对过饱和度) 决定,定向速率主要由 沉淀物的本性 决定。 ●重量分析中,沉淀的类型主要取决于 沉淀的性质(定向速度) 和 沉淀条件(聚集速度) 。 eO称重FeO,化学因子F= 2FeO/ 3FeO a形成CaCO沉淀,经灼烧得CaO产物,因此相当于CaO的KHCO·HCO的化学因子是:F= 。 3●影响沉淀纯度的因素是 共沉淀 和 后沉淀 。(12) ●重量分析对称量形式的要求是:组成和化学式符合, 称量形式稳定, 和 摩尔质量大。 H=8.0的KI溶液中的I,测定结果将会 偏低 。 3●佛尔哈德法测定时,必须先加入滴定剂 ,再加入指示剂 铁铵矾(或) 。 ●佛尔哈德法以 铁铵矾 为指示剂,酸度条件为 强酸性(0.1~1) 2●画出单波长单光束分光光度计的组成框图 。 ●光度法显色条件的选择主要有: 显色剂用量 , 酸度 , 时间 和 温度 。 3●在光度法定量分析中,参比溶液的选择非常重要。如果显色剂或其他略有吸收,应用 空白溶液 作参比溶液;如果仅配合物有色,则可用 溶剂 作参比。(12) 和 ,用普通光度法测得其透光率分别为T=20%,T=8.0%。现以A为参比,调整其吸光度为0.00,则测得B的吸光度应为 A=0.40 。 ●分光光度法用于高含量组分测定时,常采用 示差法 。 2●用普通分光光度法测定铜,测得样品的=5.0%,标液的=10.0%,如采用示差法中高含量法进行测定,则样品的= 50% ,示差法读数标尺放大了 10 倍。 ●在多组分体系中,若各种吸光物质之间没有相互作用,这是体系的总吸光度等于 各组分 吸光度之和,即吸光度具有 加和性 。 ●吸光光度法中,影响有色配合物摩尔吸收系数的主要因素是 。 ,透光率为T。当其浓度为c/2时,透光率为
二、填空(每空一分,共20分)
●有效数字是指实际能测量到的数字,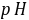 =5.00表示 2 位有效数字。
=5.00表示 2 位有效数字。
●能更好地说明测定数据分散程度的是
√A.标准偏差 B.相对偏差 C.绝对误差 D.平均偏差
●下列论述中错误的是
A. 单次测量结果的偏差之和等于零B. 标准偏差是用于衡量测定结果的分散程度
C. 系统误差呈正态分布
D. 偶然误差呈正态分布
E. 2●下列情况引起偶然误差的是
F. 重量法测定SiO2时,硅胶沉淀不完全
G. 使用腐蚀了的砝码进行称量
滴定管读数最后一位估计不准
所有试剂中含有干扰组分
2●分析结果属于系统误差是下列何种情况?(10.12)
试样未充分混匀
滴定时有液滴溅出
称量时试样吸收了空气中的水分
天平零点稍有变动
●重量分析中,沉淀溶解损失属于
过失误差
操作误差
系统误差
偶然误差
3●甲、乙二人同时分析某矿物中含硫量,每次采样3.5g,分析结果的平均值分别报告位,甲:0.042%;乙、0.04201%,则正确报告应是
甲、乙二人的报告均正确
甲的报告正确
甲、乙二人的报告均不正确
乙的报告正确
●称量法中测定黄铁矿中硫的含量,称取样品0.385g,下列分析结果合理的是
36% √
36.4%
36.41%
36.410%
●测量某试样,五次结果的平均值为32.30%,
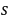 =0.13%,置信度为95%(
=0.13%,置信度为95%(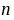 =5时,
=5时,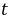 =2.7)时的置信区间报告如下,其中合理的是(12)
=2.7)时的置信区间报告如下,其中合理的是(12)32.30±0.1616162
32.30±0.162
32.30±0.1616 √
32.30±0.16
●碱式滴定管起泡未赶出,滴定过程中气泡消失,会导致
●有效数字不仅表示 数量的大小,还反映出测定的 准确程度。
H=4.765为 3 位有效数字,m = 9.27g的有效数字可看作 4 位。
H=3.24的有效数字为 2 位,lgK=8.7的有效数字为 2 位。(12)
●25.5508有 6 位有效数字,若保留3位有效数字,应按 四去六入五成双 的原则修约为 25.6 。
●对于常量组分的测定,一般要求分析结果保留 四 位有效数字,对于各种误差和偏差的计算一般要求保留 1~2 位有效数字
3●常用分析天平(万分之一)可称准至 0.1
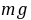 。对于一般滴定分析的准确度,要求相对误差≤0.1%,用减量法称取样品时,一般至少应称取 0.2
。对于一般滴定分析的准确度,要求相对误差≤0.1%,用减量法称取样品时,一般至少应称取 0.2 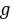 ,滴定时所用溶液体积至少要 20
,滴定时所用溶液体积至少要 20 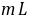 (12)
(12)2●定量分析中,系统 误差影响测定结果的准确度, 偶然 误差影响结果的精密度。
●滴定剂含有被测组分造成 系统 误差。
●某样品三次平行测定的结果为25.40、25.21、25.32,平均值为 25.31 ,相对平均偏差为 0.3% (12)
L。
●作为基准物质必须符合 、 、 和 。
●滴定分析法对滴定反应的要求是 、 、 和 。
3●0.1011
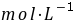
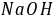 标准溶液对
标准溶液对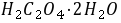 (
(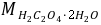 =126.07)的滴定度为 0.006425
=126.07)的滴定度为 0.006425 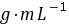 ,若滴定0.1560
,若滴定0.1560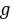 草酸试样时用去该
草酸试样时用去该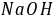 溶液22.60
溶液22.60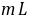 ,则试样中
,则试样中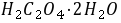 的质量分数为 63.73 。
的质量分数为 63.73 。M(
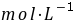 )=106.0)的滴定度为 0.005300
)=106.0)的滴定度为 0.005300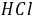 ,若滴定0.1250
,若滴定0.1250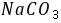
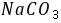 试样时用去该
试样时用去该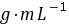 溶液22.50
溶液22.50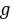 ,则试样中
,则试样中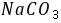 的质量分数为 95.40%。(12)
的质量分数为 95.40%。(12)●酸碱指示剂的理论变色点为 。当允许误差为±0.1%,强碱滴定一元弱酸时,目视直接滴定的条件是 。
●用0.1000
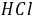
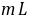 标准溶液滴定0.1000
标准溶液滴定0.1000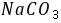
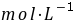 时,
时,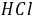 突跃为9.70~4.30;当用0.0100
突跃为9.70~4.30;当用0.0100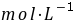
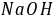 滴定0.0100
滴定0.0100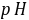
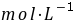 时,
时,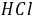 突跃为 8.70~5.30 ,可选 甲基红(或中性红 作指示剂。
突跃为 8.70~5.30 ,可选 甲基红(或中性红 作指示剂。H突跃范围的大小主要与 Kb 有关,其次还与 c 有关。(12)
●当允许误差为±0.1%,强酸滴定一元弱碱时,目视直接滴定的条件是 。
●
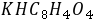 和
和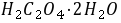 均可用来标定
均可用来标定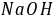 溶液,但二者相比
溶液,但二者相比 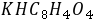 更适合用作基准物,原因是
更适合用作基准物,原因是 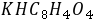 摩尔质量大,可减少称量误差。
摩尔质量大,可减少称量误差。●标定
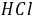 溶液浓度,可选
溶液浓度,可选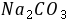 或
或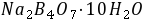 为基准物。若
为基准物。若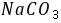 中含有水,标定结果 偏高 ,若硼砂部分失去结晶水,标定结果 偏低 。若两者均处理得当,没有以上问题,则选 硼砂 (两者之一)作为基准物更好,其原因是
中含有水,标定结果 偏高 ,若硼砂部分失去结晶水,标定结果 偏低 。若两者均处理得当,没有以上问题,则选 硼砂 (两者之一)作为基准物更好,其原因是 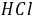 与两者均按化学计量比1﹕2反应,但硼砂摩尔质量大,称量误差小 。
与两者均按化学计量比1﹕2反应,但硼砂摩尔质量大,称量误差小 。H值的最简式为 。
H值的最简式为 。
H = pKa + lg[A-]/[HA] 。
NaH2PO4的质子平衡方程式为 [H+] + [H3PO4] = [OH-] + [HPO42-] + 2[PO43-] 。
Na2HPO4的质子平衡方程式为 。
NH4)2HPO4的质子平衡方程式(PBE)为 。
HAc+H2CO3混合溶液的质子平衡方程式(PBE)为 。
3●
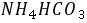 在水溶液中的质子条件是
在水溶液中的质子条件是 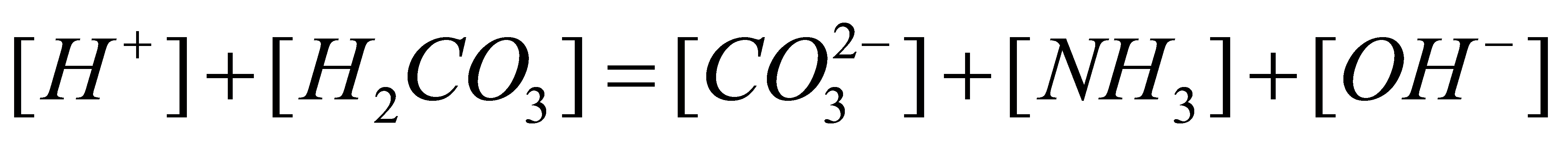 (12)
(12)[
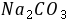 ]+[
]+[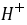 ]+[
]+[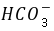 ]=[
]=[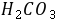 ]
]●用0.1000
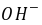
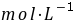 标准溶液滴定0.1000
标准溶液滴定0.1000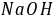 一元弱酸
一元弱酸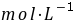 ,化学计量点时消耗
,化学计量点时消耗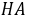 24.36
24.36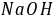 ,当消耗
,当消耗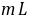 标准溶液12.18
标准溶液12.18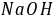 使溶液的
使溶液的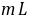 值为4.21,此一元弱酸
值为4.21,此一元弱酸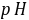 的
的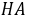 为 4.21 。
为 4.21 。2●0.1
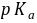 的
的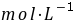 (
(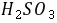 =1.82,
=1.82,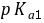 =7.00),用同浓度
=7.00),用同浓度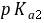 滴定时,滴定曲线上出现 2 个
滴定时,滴定曲线上出现 2 个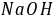 突跃。
突跃。2●用0.1
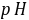
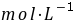 滴定同浓度的酒石酸(
滴定同浓度的酒石酸(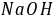 =3.04,
=3.04,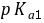 =4.37),滴定曲线有 1 个
=4.37),滴定曲线有 1 个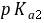 突跃。(12)
突跃。(12)●用0.1
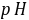
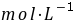 滴定同浓度的邻苯二甲酸(
滴定同浓度的邻苯二甲酸(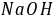 =2.89,
=2.89,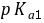 =5.54),滴定曲线有 1 个
=5.54),滴定曲线有 1 个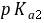 突跃。
突跃。V1﹥V2,且均大于零,则溶液的组成为
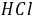 +
+ 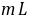 。
。2●有一混合碱液,用
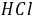 滴至酚酞终点,消耗34.12
滴至酚酞终点,消耗34.12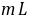 ,接着加入甲基橙,再用
,接着加入甲基橙,再用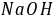 滴至橙色,又消耗盐酸15.66
滴至橙色,又消耗盐酸15.66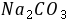 ,则此混合碱的组成为
,则此混合碱的组成为 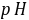 +
+ 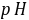 。
。M浓度为干扰离子N浓度十分之一(10倍)时,欲用控制酸度法滴定M,要求TE≤ ±0.5%,△pM≈0.3,需lgc2K’ ≥5 ,则△lgK ≥6(4) 。(12)
DTA滴定金属离子
e’时,需控制溶液的最高
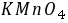 值应为 2.2 ,最低
值应为 2.2 ,最低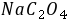 值应为 1.2 。(可参看附表附图)
值应为 1.2 。(可参看附表附图)●在
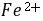 配位滴定中,为了使滴定突跃增大,一般来说,
配位滴定中,为了使滴定突跃增大,一般来说,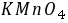 值应较大,但也不能太大,因为同时还要考虑到待测金属离子的 水解 和 指示剂 的使用范围。
值应较大,但也不能太大,因为同时还要考虑到待测金属离子的 水解 和 指示剂 的使用范围。●配位滴定法中,金属离子的配位效应计算式为 ,
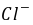 的酸效应计算式为 。
的酸效应计算式为 。2●在配位滴定中溶液的
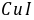 越小,
越小,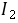 的酸效应 越大 ,条件稳定常数 越小 。
的酸效应 越大 ,条件稳定常数 越小 。DTA的酸效应是指 。
3●对于不能形成配合物或者形成的配合物不稳定的情况,需要进行配位滴定时,可采用 间接 方式。(12)
2●高锰酸钾是强氧化剂,一般在 强酸性 条件下使用;碘与硫代硫酸钠的反应应该在 中性或弱酸性 溶液中进行;而沉淀滴定法中的摩尔法只能在 中性或弱碱性(6.5-10.5)溶液中进行。(12)
244+ 3×0.059/n4 —→E426—3×0.059/n2
334+ 3×0.059/n3 →E423-3×0.059/n2+
●酸性条件下,
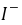 和
和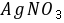 的反应速度的特点是 先慢后快再慢 ,这是因为它是 自身催化 反应,
的反应速度的特点是 先慢后快再慢 ,这是因为它是 自身催化 反应,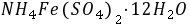 加快了
加快了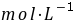 和
和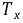 地反应,它是 诱导体 ,该反应是 诱导反应 。
地反应,它是 诱导体 ,该反应是 诱导反应 。●碘量法测铜时,由于
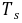 沉淀吸附
沉淀吸附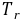 ,使结果 偏低 ,所以在接近终点时,加入的作用是 将转化为释放出被吸附的离子 。
,使结果 偏低 ,所以在接近终点时,加入的作用是 将转化为释放出被吸附的离子 。●碘量法中常用和标准溶液,滴定应在 中性或弱酸性 条件下进行,测定中含量时,应先加入过量的 溶液,再用 标准溶液滴定,指示剂淀粉溶液应在 接近计量点 时加入。
●间接碘量法的基本反应为 2-2→ 和 +2→2+ , 和的反应须在 中性或弱酸性 溶液中进行;若用间接碘量法测定电镀液中含量,指示剂应在 近终点 时加入;为防止的干扰,应加入 ,使生成 配离子。
●中铜含量的测定,用 作滴定剂,指示剂是 淀粉 ,为减少对的吸附,可加入试剂 。
HSO消化,使N转化为NHHSO,并沉淀为(NH)PtCl,再灼烧为G g的Pt,则试样中N%的计算式为 。
3●聚集速率和定向速率的相对大小直接影响沉淀的类型,其中聚集速率主要由 沉淀条件(或相对过饱和度) 决定,定向速率主要由 沉淀物的本性 决定。
●重量分析中,沉淀的类型主要取决于 沉淀的性质(定向速度) 和 沉淀条件(聚集速度) 。
eO称重FeO,化学因子F= 2FeO/ 3FeO
a形成CaCO沉淀,经灼烧得CaO产物,因此相当于CaO的KHCO·HCO的化学因子是:F= 。
3●影响沉淀纯度的因素是 共沉淀 和 后沉淀 。(12)
●重量分析对称量形式的要求是:组成和化学式符合, 称量形式稳定, 和 摩尔质量大。
H=8.0的KI溶液中的I,测定结果将会 偏低 。
3●佛尔哈德法测定时,必须先加入滴定剂 ,再加入指示剂 铁铵矾(或) 。
●佛尔哈德法以 铁铵矾 为指示剂,酸度条件为 强酸性(0.1~1)
2●画出单波长单光束分光光度计的组成框图 。
●光度法显色条件的选择主要有: 显色剂用量 , 酸度 , 时间 和 温度 。
3●在光度法定量分析中,参比溶液的选择非常重要。如果显色剂或其他略有吸收,应用 空白溶液 作参比溶液;如果仅配合物有色,则可用 溶剂 作参比。(12)
和
,用普通光度法测得其透光率分别为T=20%,T=8.0%。现以A为参比,调整其吸光度为0.00,则测得B的吸光度应为 A=0.40 。
●分光光度法用于高含量组分测定时,常采用 示差法 。
2●用普通分光光度法测定铜,测得样品的=5.0%,标液的=10.0%,如采用示差法中高含量法进行测定,则样品的= 50% ,示差法读数标尺放大了 10 倍。
●在多组分体系中,若各种吸光物质之间没有相互作用,这是体系的总吸光度等于 各组分 吸光度之和,即吸光度具有 加和性 。
●吸光光度法中,影响有色配合物摩尔吸收系数的主要因素是 。
,透光率为T。当其浓度为c/2时,透光率为
题目解答
答案
[H + ] + [H 3 PO 4 ] = [OH - ] + [HPO 4 2- ] + 2[PO 4 3- ]