题目
12.9 计算500g氧气在温度为0℃时分子的平均动能,当温度由0℃上升到25℃时,氧气-|||-内能的变化为多少?
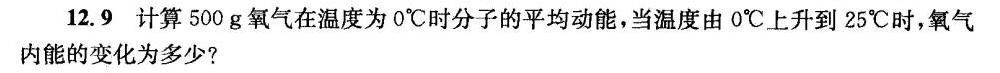
题目解答
答案
解析
题目12.9分析
本题考查理想气体分子平均动能、内能变化的计算,涉及热力学能公式及温度对分子动能的影响。
步骤1:计算0℃时氧气分子的平均动能
氧气($O_2$)为双原子分子,常温下视为刚性分子,自由度$i=5$(3个平动+2个转动)。
分子平均动能公式:
$\overline{\epsilon_k} = \frac{i}{2}kT$
其中:
- 玻尔兹曼常数$k=1.38\times10^{-23}\,\text{J/K}$
- 热力学温度$T=0^\circ\text{C}=273.15\,\text{K}$
代入计算:
$\overline{\epsilon_k} = \frac{5}{2}\times1.38\times10^{-23}\times273.15 \approx 9.41\times10^{-21}\,\text{J}$
步骤2:计算温度从0℃到25℃时氧气内能的变化
氧气视为理想气体,内能仅与温度有关,公式:
$\Delta U = \nu\frac{i}{2}R\Delta T$
其中:
- 物质的量$\nu=\frac{m}{M}$,$m=500\,\text{g}=0.5\,\text{kg}$,$M=32\,\text{g/mol}=0.032\,\text{kg/mol}$
- 气体常数$R=8.31\,\text{J/(mol·K)}$
- 温度变化$\Delta T=25\,\text{K}$($25^\circ\text{C}-0^\circ\text{C}$)
计算物质的量:
$\nu=\frac{0.5}{0.032}\approx15.625\,\text{mol}$
代入内能变化公式:
$\Delta U=15.625\times\frac{5}{2}\times8.31\times25\approx8.12\times10^2\,\text{J}$