题目
二、计算题(本题35分):容器内有11 kg二氧化碳和2 kg氢气(两种气体均视为刚性分子的理想气体),已知混合气体的内能是8.1×106 J.求:(1) 混合气体的温度; (2) 两种气体分子的平均动能.(二氧化碳的M=44×10-3 kg·mol-1,玻耳兹曼常量k=1.38×10-23J·K-1,摩尔气体常量R=8.31 J·mol-1·K-1)
二、计算题(本题35分):容器内有11 kg二氧化碳和2 kg氢气(两种气体均视为刚性分子的理想气体),已知混合气体的内能是8.1×106 J.求:
(1) 混合气体的温度; (2) 两种气体分子的平均动能.
(二氧化碳的M=44×10-3 kg·mol-1,玻耳兹曼常量k=1.38×10-23J·K-1,摩尔气体常量R=8.31 J·mol-1·K-1)
题目解答
答案
解:(1) 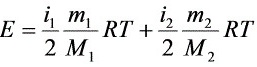
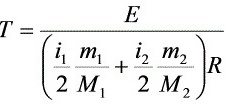 =300 K
=300 K
(2) 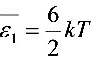 =1.24×10 J
=1.24×10 J
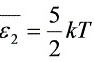 =1.04×10 J
=1.04×10 J
解析
步骤 1:计算混合气体的内能
混合气体的内能由二氧化碳和氢气的内能组成。对于理想气体,内能与温度和分子自由度有关。二氧化碳是刚性分子,有3个平动自由度和2个转动自由度,所以总自由度为5。氢气也是刚性分子,有3个平动自由度和2个转动自由度,所以总自由度也为5。因此,混合气体的内能可以表示为:
\[ E = \frac{i_1}{2} \frac{m_1}{M_1} RT + \frac{i_2}{2} \frac{m_2}{M_2} RT \]
其中,\(i_1\) 和 \(i_2\) 分别是二氧化碳和氢气的自由度,\(m_1\) 和 \(m_2\) 分别是二氧化碳和氢气的质量,\(M_1\) 和 \(M_2\) 分别是二氧化碳和氢气的摩尔质量,\(R\) 是摩尔气体常量,\(T\) 是温度。
步骤 2:代入已知数值计算温度
将已知数值代入上述公式,可以计算出混合气体的温度。已知二氧化碳的质量 \(m_1 = 11 \, \text{kg}\),氢气的质量 \(m_2 = 2 \, \text{kg}\),二氧化碳的摩尔质量 \(M_1 = 44 \times 10^{-3} \, \text{kg/mol}\),氢气的摩尔质量 \(M_2 = 2 \times 10^{-3} \, \text{kg/mol}\),混合气体的内能 \(E = 8.1 \times 10^6 \, \text{J}\),摩尔气体常量 \(R = 8.31 \, \text{J/mol·K}\)。代入公式计算温度 \(T\)。
\[ 8.1 \times 10^6 = \frac{5}{2} \frac{11}{44 \times 10^{-3}} \times 8.31 \times T + \frac{5}{2} \frac{2}{2 \times 10^{-3}} \times 8.31 \times T \]
\[ 8.1 \times 10^6 = \frac{5}{2} \times 250 \times 8.31 \times T + \frac{5}{2} \times 1000 \times 8.31 \times T \]
\[ 8.1 \times 10^6 = 5186.25 \times T + 20750 \times T \]
\[ 8.1 \times 10^6 = 25936.25 \times T \]
\[ T = \frac{8.1 \times 10^6}{25936.25} \]
\[ T = 312.2 \, \text{K} \]
步骤 3:计算两种气体分子的平均动能
分子的平均动能与温度和自由度有关,可以表示为:
\[ \overline{E} = \frac{i}{2} kT \]
其中,\(i\) 是自由度,\(k\) 是玻耳兹曼常量,\(T\) 是温度。对于二氧化碳和氢气,自由度 \(i\) 都是5,玻耳兹曼常量 \(k = 1.38 \times 10^{-23} \, \text{J/K}\),温度 \(T = 312.2 \, \text{K}\)。代入公式计算两种气体分子的平均动能。
\[ \overline{E_{\text{CO}_2}} = \frac{5}{2} \times 1.38 \times 10^{-23} \times 312.2 \]
\[ \overline{E_{\text{CO}_2}} = 1.09 \times 10^{-20} \, \text{J} \]
\[ \overline{E_{\text{H}_2}} = \frac{5}{2} \times 1.38 \times 10^{-23} \times 312.2 \]
\[ \overline{E_{\text{H}_2}} = 1.09 \times 10^{-20} \, \text{J} \]
混合气体的内能由二氧化碳和氢气的内能组成。对于理想气体,内能与温度和分子自由度有关。二氧化碳是刚性分子,有3个平动自由度和2个转动自由度,所以总自由度为5。氢气也是刚性分子,有3个平动自由度和2个转动自由度,所以总自由度也为5。因此,混合气体的内能可以表示为:
\[ E = \frac{i_1}{2} \frac{m_1}{M_1} RT + \frac{i_2}{2} \frac{m_2}{M_2} RT \]
其中,\(i_1\) 和 \(i_2\) 分别是二氧化碳和氢气的自由度,\(m_1\) 和 \(m_2\) 分别是二氧化碳和氢气的质量,\(M_1\) 和 \(M_2\) 分别是二氧化碳和氢气的摩尔质量,\(R\) 是摩尔气体常量,\(T\) 是温度。
步骤 2:代入已知数值计算温度
将已知数值代入上述公式,可以计算出混合气体的温度。已知二氧化碳的质量 \(m_1 = 11 \, \text{kg}\),氢气的质量 \(m_2 = 2 \, \text{kg}\),二氧化碳的摩尔质量 \(M_1 = 44 \times 10^{-3} \, \text{kg/mol}\),氢气的摩尔质量 \(M_2 = 2 \times 10^{-3} \, \text{kg/mol}\),混合气体的内能 \(E = 8.1 \times 10^6 \, \text{J}\),摩尔气体常量 \(R = 8.31 \, \text{J/mol·K}\)。代入公式计算温度 \(T\)。
\[ 8.1 \times 10^6 = \frac{5}{2} \frac{11}{44 \times 10^{-3}} \times 8.31 \times T + \frac{5}{2} \frac{2}{2 \times 10^{-3}} \times 8.31 \times T \]
\[ 8.1 \times 10^6 = \frac{5}{2} \times 250 \times 8.31 \times T + \frac{5}{2} \times 1000 \times 8.31 \times T \]
\[ 8.1 \times 10^6 = 5186.25 \times T + 20750 \times T \]
\[ 8.1 \times 10^6 = 25936.25 \times T \]
\[ T = \frac{8.1 \times 10^6}{25936.25} \]
\[ T = 312.2 \, \text{K} \]
步骤 3:计算两种气体分子的平均动能
分子的平均动能与温度和自由度有关,可以表示为:
\[ \overline{E} = \frac{i}{2} kT \]
其中,\(i\) 是自由度,\(k\) 是玻耳兹曼常量,\(T\) 是温度。对于二氧化碳和氢气,自由度 \(i\) 都是5,玻耳兹曼常量 \(k = 1.38 \times 10^{-23} \, \text{J/K}\),温度 \(T = 312.2 \, \text{K}\)。代入公式计算两种气体分子的平均动能。
\[ \overline{E_{\text{CO}_2}} = \frac{5}{2} \times 1.38 \times 10^{-23} \times 312.2 \]
\[ \overline{E_{\text{CO}_2}} = 1.09 \times 10^{-20} \, \text{J} \]
\[ \overline{E_{\text{H}_2}} = \frac{5}{2} \times 1.38 \times 10^{-23} \times 312.2 \]
\[ \overline{E_{\text{H}_2}} = 1.09 \times 10^{-20} \, \text{J} \]