题目
一容器内储有氧气,温度为 27℃,其压强为https:/img.zuoyebang.cc/zyb_fd73ee53038b4be1a64334c9d3de628a.jpg.02times (10)^5Pa,求: (1)气体分子数密度; (2)氧气的密度; (3)分子的平均平动动能; (4)分子间的平均距离。
一容器内储有氧气,温度为 27℃,其压强为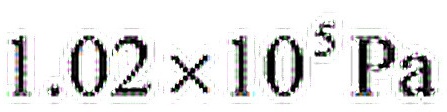 ,求: (1)气体分子数密度; (2)氧气的密度; (3)分子的平均平动动能; (4)分子间的平均距离。
,求: (1)气体分子数密度; (2)氧气的密度; (3)分子的平均平动动能; (4)分子间的平均距离。
题目解答
答案
解: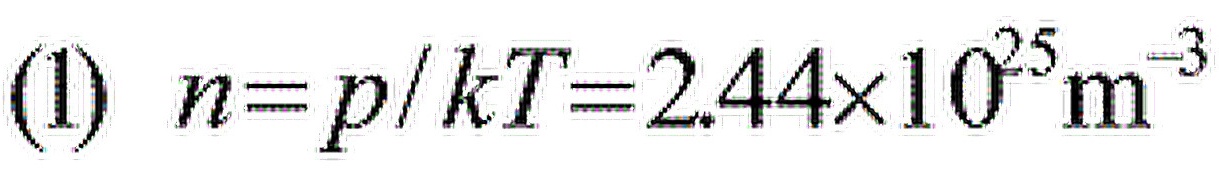
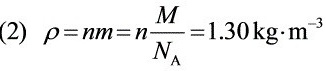
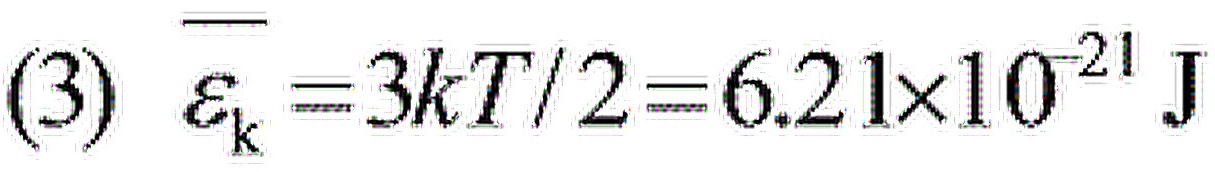
解析
步骤 1:计算气体分子数密度
根据理想气体状态方程,$pV=nRT$,其中$p$是压强,$V$是体积,$n$是物质的量,$R$是理想气体常数,$T$是温度。分子数密度$n$可以通过$pV=nRT$变形得到$n=p/(kT)$,其中$k$是玻尔兹曼常数,$T$是绝对温度。将已知的压强和温度代入,可以计算出分子数密度。
步骤 2:计算氧气的密度
氧气的密度可以通过分子数密度乘以单个分子的质量得到。单个分子的质量可以通过氧气的摩尔质量除以阿伏伽德罗常数得到。因此,氧气的密度$\rho = nm = n\dfrac{M}{{N}_{A}}$,其中$M$是氧气的摩尔质量,${N}_{A}$是阿伏伽德罗常数。
步骤 3:计算分子的平均平动动能
分子的平均平动动能可以通过公式${\varepsilon }_{k}=3kT/2$计算,其中$k$是玻尔兹曼常数,$T$是绝对温度。
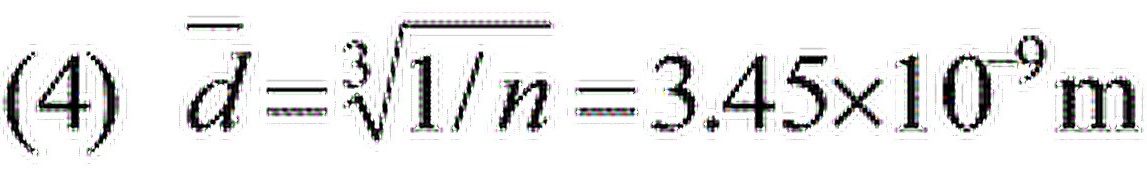
步骤 4:计算分子间的平均距离
分子间的平均距离可以通过分子数密度的立方根计算,即$\overline{d}=\sqrt[3]{1/n}$。
根据理想气体状态方程,$pV=nRT$,其中$p$是压强,$V$是体积,$n$是物质的量,$R$是理想气体常数,$T$是温度。分子数密度$n$可以通过$pV=nRT$变形得到$n=p/(kT)$,其中$k$是玻尔兹曼常数,$T$是绝对温度。将已知的压强和温度代入,可以计算出分子数密度。
步骤 2:计算氧气的密度
氧气的密度可以通过分子数密度乘以单个分子的质量得到。单个分子的质量可以通过氧气的摩尔质量除以阿伏伽德罗常数得到。因此,氧气的密度$\rho = nm = n\dfrac{M}{{N}_{A}}$,其中$M$是氧气的摩尔质量,${N}_{A}$是阿伏伽德罗常数。
步骤 3:计算分子的平均平动动能
分子的平均平动动能可以通过公式${\varepsilon }_{k}=3kT/2$计算,其中$k$是玻尔兹曼常数,$T$是绝对温度。
步骤 4:计算分子间的平均距离
分子间的平均距离可以通过分子数密度的立方根计算,即$\overline{d}=\sqrt[3]{1/n}$。