题目
5-1 有2.3kg的CO,初态时 _(1)=477k _(1)=0.32mPa, 经可逆定容加热达-|||-终温 _(2)=600k 设CO为理想气体,求 △U. Delta H △S、 过程功及过程热量。-|||-(1)按比热容为定值计算;(2)比热容为变值,按气体性质表计算。

题目解答
答案
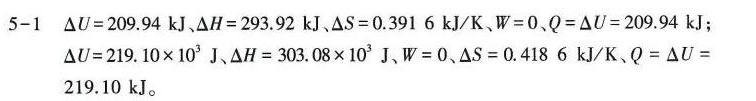
解析
步骤 1:计算定值比热容下的内能变化
根据理想气体的内能变化公式,$\Delta U = mC_v\Delta T$,其中 $m$ 是质量,$C_v$ 是定值比热容,$\Delta T$ 是温度变化。对于一摩尔的CO,$C_v = 28.8 J/(mol\cdot K)$,而 $m = 2.3 kg$,$M_{CO} = 28 g/mol$,所以 $n = \frac{m}{M_{CO}} = \frac{2.3 \times 10^3}{28} mol$。$\Delta T = T_2 - T_1 = 600K - 477K = 123K$。因此,$\Delta U = nC_v\Delta T$。
步骤 2:计算定值比热容下的焓变
根据理想气体的焓变公式,$\Delta H = mC_p\Delta T$,其中 $C_p$ 是定值比热容,$C_p = C_v + R$,$R$ 是理想气体常数,$R = 8.314 J/(mol\cdot K)$。因此,$\Delta H = nC_p\Delta T$。
步骤 3:计算过程功
由于是定容过程,体积不变,所以过程功 $W = 0$。
步骤 4:计算过程热量
根据热力学第一定律,$Q = \Delta U + W$,由于 $W = 0$,所以 $Q = \Delta U$。
步骤 5:计算变值比热容下的内能变化和焓变
根据气体性质表,查出CO在不同温度下的比热容,计算出平均比热容,然后用平均比热容计算内能变化和焓变。
步骤 6:计算变值比热容下的熵变
根据气体性质表,查出CO在不同温度下的熵值,计算出熵变。
根据理想气体的内能变化公式,$\Delta U = mC_v\Delta T$,其中 $m$ 是质量,$C_v$ 是定值比热容,$\Delta T$ 是温度变化。对于一摩尔的CO,$C_v = 28.8 J/(mol\cdot K)$,而 $m = 2.3 kg$,$M_{CO} = 28 g/mol$,所以 $n = \frac{m}{M_{CO}} = \frac{2.3 \times 10^3}{28} mol$。$\Delta T = T_2 - T_1 = 600K - 477K = 123K$。因此,$\Delta U = nC_v\Delta T$。
步骤 2:计算定值比热容下的焓变
根据理想气体的焓变公式,$\Delta H = mC_p\Delta T$,其中 $C_p$ 是定值比热容,$C_p = C_v + R$,$R$ 是理想气体常数,$R = 8.314 J/(mol\cdot K)$。因此,$\Delta H = nC_p\Delta T$。
步骤 3:计算过程功
由于是定容过程,体积不变,所以过程功 $W = 0$。
步骤 4:计算过程热量
根据热力学第一定律,$Q = \Delta U + W$,由于 $W = 0$,所以 $Q = \Delta U$。
步骤 5:计算变值比热容下的内能变化和焓变
根据气体性质表,查出CO在不同温度下的比热容,计算出平均比热容,然后用平均比热容计算内能变化和焓变。
步骤 6:计算变值比热容下的熵变
根据气体性质表,查出CO在不同温度下的熵值,计算出熵变。