题目
2mol某理想气体的(C)_(p,m)=3.5R。由始态100kPa,50d(m)^3,先恒容加热使压力升高到200kPa,再恒压冷却使体积缩小至25d(m)^3。求整个过程的W,Q,Delta U和Delta H。
2mol某理想气体的${C}_{p,m}=3.5R$。由始态100kPa,$50d{m}^{3}$,先恒容加热使压力升高到200kPa,再恒压冷却使体积缩小至$25d{m}^{3}$。求整个过程的W,Q,$\Delta U$和$\Delta H$。
题目解答
答案
【答案】
$W=5kJ$;$Q=-5kJ$;$\Delta H=\Delta U=0$
【解析】
过程图如下所示:
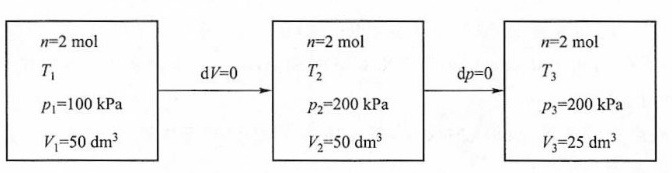
由题意可得:${p}_{1}{V}_{1}={p}_{3}{V}_{3}$,故${T}_{1}={T}_{3}$,由于理想气体H与U只是温度的函数,所以整个过程$\Delta H=\Delta U=0$;$W={W}_{2}=-{p}_{amb}\Delta V=\left[-200\times {10}^{3}\times \left(25\times {10}^{-3}-50\times {10}^{-3}\right)\right]J=5kJ$
根据热力学第一定律可得:$Q=\Delta U-W=\left(0-5\right)kJ=-5kJ$。
解析
考查要点:本题主要考查理想气体在两个不同过程中的热力学量计算,涉及恒容过程和恒压过程的功、热量、内能及焓变的分析。
解题核心思路:
- 判断温度变化:通过理想气体状态方程分析初态和终态的温度关系,发现温度相等,从而得出$\Delta U$和$\Delta H$为零。
- 分步计算功:恒容过程无功,恒压过程的功由体积变化决定。
- 热力学第一定律:通过$\Delta U = Q + W$(或变体公式)计算热量。
破题关键点:
- 理想气体性质:内能和焓仅是温度的函数。
- 状态方程应用:通过$pV = nRT$比较初态和终态温度。
- 功的计算:区分恒容和恒压过程的功,注意单位换算。
步骤1:分析温度变化
- 初态(1):$p_1 = 100 \, \text{kPa}$,$V_1 = 50 \, \text{dm}^3$,温度$T_1 = \frac{p_1 V_1}{nR} = \frac{100 \times 50}{2R} = \frac{2500}{R}$。
- 终态(3):$p_3 = 200 \, \text{kPa}$,$V_3 = 25 \, \text{dm}^3$,温度$T_3 = \frac{p_3 V_3}{nR} = \frac{200 \times 25}{2R} = \frac{2500}{R}$。
- 结论:$T_1 = T_3$,因此$\Delta U = 0$,$\Delta H = 0$。
步骤2:计算功$W$
- 恒容过程(1→2):体积不变,$W_1 = 0$。
- 恒压过程(2→3):体积变化$\Delta V = 25 \, \text{dm}^3 - 50 \, \text{dm}^3 = -25 \, \text{dm}^3$,功为:
$W_2 = -p_{\text{外}} \Delta V = -200 \, \text{kPa} \times (-25 \, \text{dm}^3) = 5 \, \text{kJ}.$ - 总功:$W = W_1 + W_2 = 5 \, \text{kJ}$。
步骤3:计算热量$Q$
根据热力学第一定律$\Delta U = Q + W$,代入$\Delta U = 0$和$W = 5 \, \text{kJ}$:
$Q = -W = -5 \, \text{kJ}.$