题目
2.将温度为300K,压强为1800 kPa的钢瓶中的氮气放一部分到体积为20 dm^3的储气瓶中,使储气瓶-|||-压强在300K时为100 kPa,这时原来钢瓶中的压强降为1600 kPa(假设温度未变)。试求原钢瓶的体积。设气-|||-体为理想气体。

题目解答
答案
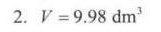
解析
步骤 1:确定理想气体状态方程
理想气体状态方程为 $PV=nRT$,其中 $P$ 是压强,$V$ 是体积,$n$ 是物质的量,$R$ 是理想气体常数,$T$ 是温度。由于题目中温度不变,可以使用玻意耳定律 $P_1V_1=P_2V_2$ 来解决这个问题。
步骤 2:计算储气瓶中氮气的物质的量
储气瓶中氮气的压强为 $100 kPa$,体积为 $20 dm^3$,温度为 $300 K$。根据理想气体状态方程,可以计算出储气瓶中氮气的物质的量 $n$。
$$
n = \frac{PV}{RT} = \frac{100 \times 10^3 \times 20 \times 10^{-3}}{8.314 \times 300} = \frac{2000}{2494.2} = 0.802 mol
$$
步骤 3:计算原钢瓶中氮气的物质的量
原钢瓶中氮气的压强为 $1800 kPa$,温度为 $300 K$。根据理想气体状态方程,可以计算出原钢瓶中氮气的物质的量 $n_1$。
$$
n_1 = \frac{P_1V_1}{RT} = \frac{1800 \times 10^3 \times V_1}{8.314 \times 300} = \frac{1800 \times 10^3 \times V_1}{2494.2}
$$
其中 $V_1$ 是原钢瓶的体积。
步骤 4:计算剩余氮气的物质的量
剩余氮气的压强为 $1600 kPa$,温度为 $300 K$。根据理想气体状态方程,可以计算出剩余氮气的物质的量 $n_2$。
$$
n_2 = \frac{P_2V_2}{RT} = \frac{1600 \times 10^3 \times V_1}{8.314 \times 300} = \frac{1600 \times 10^3 \times V_1}{2494.2}
$$
其中 $V_1$ 是原钢瓶的体积。
步骤 5:计算原钢瓶的体积
根据步骤 2、步骤 3 和步骤 4,可以得到原钢瓶中氮气的物质的量 $n_1$ 等于储气瓶中氮气的物质的量 $n$ 加上剩余氮气的物质的量 $n_2$。
$$
n_1 = n + n_2
$$
$$
\frac{1800 \times 10^3 \times V_1}{2494.2} = 0.802 + \frac{1600 \times 10^3 \times V_1}{2494.2}
$$
$$
\frac{1800 \times 10^3 \times V_1}{2494.2} - \frac{1600 \times 10^3 \times V_1}{2494.2} = 0.802
$$
$$
\frac{200 \times 10^3 \times V_1}{2494.2} = 0.802
$$
$$
V_1 = \frac{0.802 \times 2494.2}{200 \times 10^3} = 9.98 dm^3
$$
理想气体状态方程为 $PV=nRT$,其中 $P$ 是压强,$V$ 是体积,$n$ 是物质的量,$R$ 是理想气体常数,$T$ 是温度。由于题目中温度不变,可以使用玻意耳定律 $P_1V_1=P_2V_2$ 来解决这个问题。
步骤 2:计算储气瓶中氮气的物质的量
储气瓶中氮气的压强为 $100 kPa$,体积为 $20 dm^3$,温度为 $300 K$。根据理想气体状态方程,可以计算出储气瓶中氮气的物质的量 $n$。
$$
n = \frac{PV}{RT} = \frac{100 \times 10^3 \times 20 \times 10^{-3}}{8.314 \times 300} = \frac{2000}{2494.2} = 0.802 mol
$$
步骤 3:计算原钢瓶中氮气的物质的量
原钢瓶中氮气的压强为 $1800 kPa$,温度为 $300 K$。根据理想气体状态方程,可以计算出原钢瓶中氮气的物质的量 $n_1$。
$$
n_1 = \frac{P_1V_1}{RT} = \frac{1800 \times 10^3 \times V_1}{8.314 \times 300} = \frac{1800 \times 10^3 \times V_1}{2494.2}
$$
其中 $V_1$ 是原钢瓶的体积。
步骤 4:计算剩余氮气的物质的量
剩余氮气的压强为 $1600 kPa$,温度为 $300 K$。根据理想气体状态方程,可以计算出剩余氮气的物质的量 $n_2$。
$$
n_2 = \frac{P_2V_2}{RT} = \frac{1600 \times 10^3 \times V_1}{8.314 \times 300} = \frac{1600 \times 10^3 \times V_1}{2494.2}
$$
其中 $V_1$ 是原钢瓶的体积。
步骤 5:计算原钢瓶的体积
根据步骤 2、步骤 3 和步骤 4,可以得到原钢瓶中氮气的物质的量 $n_1$ 等于储气瓶中氮气的物质的量 $n$ 加上剩余氮气的物质的量 $n_2$。
$$
n_1 = n + n_2
$$
$$
\frac{1800 \times 10^3 \times V_1}{2494.2} = 0.802 + \frac{1600 \times 10^3 \times V_1}{2494.2}
$$
$$
\frac{1800 \times 10^3 \times V_1}{2494.2} - \frac{1600 \times 10^3 \times V_1}{2494.2} = 0.802
$$
$$
\frac{200 \times 10^3 \times V_1}{2494.2} = 0.802
$$
$$
V_1 = \frac{0.802 \times 2494.2}{200 \times 10^3} = 9.98 dm^3
$$