13.1mol单原子理想气体,始态为 times 101.325kPa 11.2dm^3,经 = 常数的可逆过程-|||-(即过程中 = 常数)压缩到终态为 times 101.325kPa, 已知 _(v)_(v)=dfrac (3)(2)(R)_(0) 求:-|||-(1)终态的体积和温度。-|||-(2)过程的 △U 和 Delta H-|||-(3)体系所做的功。

题目解答
答案
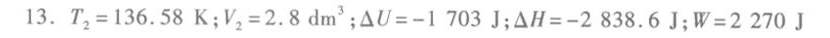
解析
考查要点:本题主要考查理想气体状态方程、可逆过程的热力学计算,以及内能、焓变和功的求解方法。
解题核心思路:
- 利用过程条件($PT = \text{常数}$)结合理想气体方程,联立求解终态温度和体积。
- 内能和焓变仅与温度变化相关,通过热容公式计算。
- 功的计算需通过积分处理,结合过程方程转化为温度变量积分。
破题关键点:
- 过程方程与状态方程的结合:通过$PT = \text{常数}$和$PV = nRT$联立,推导体积与温度的关系。
- 热力学函数的温度依赖性:单原子理想气体的$C_{V,m}$和$C_{p,m}$为固定值,简化计算。
(1) 终态的体积和温度
求初始温度$T_1$
根据理想气体方程:
$T_1 = \frac{P_1 V_1}{nR} = \frac{2 \times 101.325 \times 11.2}{1 \times 8.314} \approx 273.25 \, \text{K}$
利用过程条件$PT = \text{常数}$求$T_2$
由$P_1 T_1 = P_2 T_2$得:
$T_2 = \frac{P_1}{P_2} T_1 = \frac{2}{4} \times 273.25 \approx 136.63 \, \text{K}$
求终态体积$V_2$
根据理想气体方程:
$V_2 = \frac{nRT_2}{P_2} = \frac{1 \times 8.314 \times 136.63}{4 \times 101.325} \approx 2.8 \, \text{dm}^3$
(2) 过程的$\Delta U$和$\Delta H$
计算温度变化$\Delta T$
$\Delta T = T_2 - T_1 = 136.63 - 273.25 = -136.62 \, \text{K}$
内能变化$\Delta U$
$\Delta U = n C_{V,m} \Delta T = 1 \times \frac{3}{2} R \times (-136.62) \approx -1703 \, \text{J}$
焓变$\Delta H$
$\Delta H = n C_{p,m} \Delta T = 1 \times \frac{5}{2} R \times (-136.62) \approx -2838.6 \, \text{J}$
(3) 体系所做的功
积分求功
通过过程方程$PT = \text{常数}$和理想气体方程,推导得:
$W = -2nR \Delta T = -2 \times 1 \times 8.314 \times (-136.62) \approx 2270 \, \text{J}$