题目
已知氢原子第一激发态(E2)与基态(E1)之间能量差为1.64×l0-18J,设火焰(T=2700K)中含有1020个氢原子。设原子按玻尔兹曼分布,且4g1=g2。求:(1)能级E2上的原子数n2为多少?(2)设火焰中每秒发射的光子数为l08 n2,求光的功率为多少瓦?
已知氢原子第一激发态(E2)与基态(E1)之间能量差为1.64×l0-18J,设火焰(T=2700K)中含有1020个氢原子。设原子按玻尔兹曼分布,且4g1=g2。求:(1)能级E2上的原子数n2为多少?(2)设火焰中每秒发射的光子数为l08 n2,求光的功率为多少瓦?
题目解答
答案
答:(1)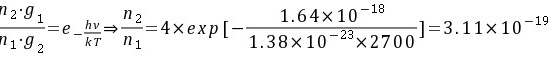
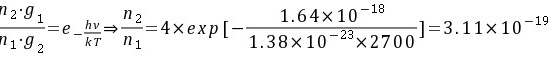
且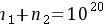 可求出
可求出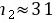
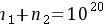 可求出
可求出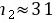
(2)功率=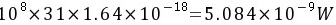
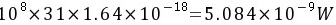
解析
步骤 1:计算玻尔兹曼分布中的比例因子
根据玻尔兹曼分布,能级E2上的原子数n2与基态E1上的原子数n1之间的关系为:
\[ \frac{n_2}{n_1} = \frac{g_2}{g_1} e^{-\frac{E_2 - E_1}{kT}} \]
其中,\( g_1 \) 和 \( g_2 \) 分别是基态和第一激发态的简并度,\( k \) 是玻尔兹曼常数,\( T \) 是温度。已知 \( g_2 = 4g_1 \),\( E_2 - E_1 = 1.64 \times 10^{-18} \) J,\( T = 2700 \) K,\( k = 1.38 \times 10^{-23} \) J/K。代入公式计算比例因子:
\[ \frac{n_2}{n_1} = 4 e^{-\frac{1.64 \times 10^{-18}}{1.38 \times 10^{-23} \times 2700}} \]
步骤 2:计算能级E2上的原子数n2
已知总原子数 \( n_1 + n_2 = 10^{20} \),代入步骤1中的比例因子,解方程求出 \( n_2 \):
\[ n_2 = \frac{4 e^{-\frac{1.64 \times 10^{-18}}{1.38 \times 10^{-23} \times 2700}}}{1 + 4 e^{-\frac{1.64 \times 10^{-18}}{1.38 \times 10^{-23} \times 2700}}} \times 10^{20} \]
步骤 3:计算光的功率
已知每秒发射的光子数为 \( 10^8 n_2 \),光的功率为每秒发射的光子数乘以每个光子的能量:
\[ P = 10^8 n_2 \times (E_2 - E_1) \]
根据玻尔兹曼分布,能级E2上的原子数n2与基态E1上的原子数n1之间的关系为:
\[ \frac{n_2}{n_1} = \frac{g_2}{g_1} e^{-\frac{E_2 - E_1}{kT}} \]
其中,\( g_1 \) 和 \( g_2 \) 分别是基态和第一激发态的简并度,\( k \) 是玻尔兹曼常数,\( T \) 是温度。已知 \( g_2 = 4g_1 \),\( E_2 - E_1 = 1.64 \times 10^{-18} \) J,\( T = 2700 \) K,\( k = 1.38 \times 10^{-23} \) J/K。代入公式计算比例因子:
\[ \frac{n_2}{n_1} = 4 e^{-\frac{1.64 \times 10^{-18}}{1.38 \times 10^{-23} \times 2700}} \]
步骤 2:计算能级E2上的原子数n2
已知总原子数 \( n_1 + n_2 = 10^{20} \),代入步骤1中的比例因子,解方程求出 \( n_2 \):
\[ n_2 = \frac{4 e^{-\frac{1.64 \times 10^{-18}}{1.38 \times 10^{-23} \times 2700}}}{1 + 4 e^{-\frac{1.64 \times 10^{-18}}{1.38 \times 10^{-23} \times 2700}}} \times 10^{20} \]
步骤 3:计算光的功率
已知每秒发射的光子数为 \( 10^8 n_2 \),光的功率为每秒发射的光子数乘以每个光子的能量:
\[ P = 10^8 n_2 \times (E_2 - E_1) \]