题目
1、64g的氧气的温度由0℃升至50℃,(1)保持体积不变;(2)保持压强不变.在这两个过程中氧-|||-气各吸收了多少热量?各增加了多少内能?对外各做了多少功?

题目解答
答案
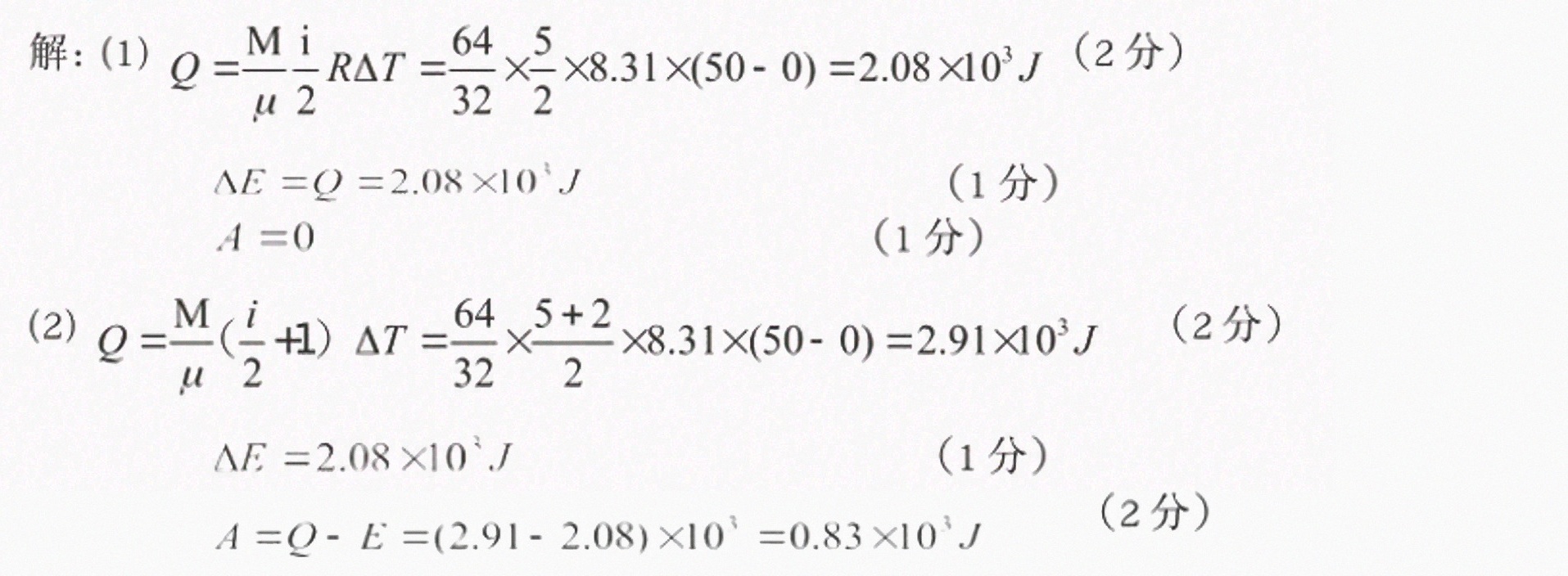
解析
步骤 1:计算氧气的摩尔数
氧气的摩尔质量为32g/mol,因此64g氧气的摩尔数为:
$$
n = \frac{64\text{g}}{32\text{g/mol}} = 2\text{mol}
$$
步骤 2:计算体积不变时的热量吸收和内能增加
对于理想气体,当体积不变时,吸收的热量全部用于增加内能。氧气是双原子分子,其摩尔定容热容为:
$$
C_V = \frac{5}{2}R
$$
其中R为理想气体常数,R = 8.31 J/(mol·K)。因此,体积不变时吸收的热量为:
$$
Q_1 = nC_V\Delta T = 2\text{mol} \times \frac{5}{2} \times 8.31\text{J/(mol·K)} \times (50 - 0)\text{K} = 2.08 \times 10^3\text{J}
$$
内能增加量等于吸收的热量,即:
$$
\Delta E_1 = Q_1 = 2.08 \times 10^3\text{J}
$$
由于体积不变,对外做的功为0。
步骤 3:计算压强不变时的热量吸收、内能增加和对外做功
对于理想气体,当压强不变时,吸收的热量用于增加内能和对外做功。氧气的摩尔定压热容为:
$$
C_P = \frac{7}{2}R
$$
因此,压强不变时吸收的热量为:
$$
Q_2 = nC_P\Delta T = 2\text{mol} \times \frac{7}{2} \times 8.31\text{J/(mol·K)} \times (50 - 0)\text{K} = 2.91 \times 10^3\text{J}
$$
内能增加量为:
$$
\Delta E_2 = nC_V\Delta T = 2\text{mol} \times \frac{5}{2} \times 8.31\text{J/(mol·K)} \times (50 - 0)\text{K} = 2.08 \times 10^3\text{J}
$$
对外做的功为:
$$
A = Q_2 - \Delta E_2 = (2.91 - 2.08) \times 10^3\text{J} = 0.83 \times 10^3\text{J}
$$
氧气的摩尔质量为32g/mol,因此64g氧气的摩尔数为:
$$
n = \frac{64\text{g}}{32\text{g/mol}} = 2\text{mol}
$$
步骤 2:计算体积不变时的热量吸收和内能增加
对于理想气体,当体积不变时,吸收的热量全部用于增加内能。氧气是双原子分子,其摩尔定容热容为:
$$
C_V = \frac{5}{2}R
$$
其中R为理想气体常数,R = 8.31 J/(mol·K)。因此,体积不变时吸收的热量为:
$$
Q_1 = nC_V\Delta T = 2\text{mol} \times \frac{5}{2} \times 8.31\text{J/(mol·K)} \times (50 - 0)\text{K} = 2.08 \times 10^3\text{J}
$$
内能增加量等于吸收的热量,即:
$$
\Delta E_1 = Q_1 = 2.08 \times 10^3\text{J}
$$
由于体积不变,对外做的功为0。
步骤 3:计算压强不变时的热量吸收、内能增加和对外做功
对于理想气体,当压强不变时,吸收的热量用于增加内能和对外做功。氧气的摩尔定压热容为:
$$
C_P = \frac{7}{2}R
$$
因此,压强不变时吸收的热量为:
$$
Q_2 = nC_P\Delta T = 2\text{mol} \times \frac{7}{2} \times 8.31\text{J/(mol·K)} \times (50 - 0)\text{K} = 2.91 \times 10^3\text{J}
$$
内能增加量为:
$$
\Delta E_2 = nC_V\Delta T = 2\text{mol} \times \frac{5}{2} \times 8.31\text{J/(mol·K)} \times (50 - 0)\text{K} = 2.08 \times 10^3\text{J}
$$
对外做的功为:
$$
A = Q_2 - \Delta E_2 = (2.91 - 2.08) \times 10^3\text{J} = 0.83 \times 10^3\text{J}
$$