b-|||-a c-|||-v-|||-图 4-18-|||-p b-|||-丁.-|||-T。-|||-a-|||-O v-|||-图 4-18 题解如图4-18所示,今有两个任意过程 a -b及a-C, b点及c点在同一 条绝热线上,(1)试问.-:Uab与.":Uac哪个大? (2)若b点及C点在同一条定温线上,结果又如何?依题意,Tb>Tc,所以AUab>.;Uac。若b点及C点在同一条定温线上, 则匚 uab= ■: Uac°10•理想气体定温过程的膨胀功等于技术功能否推广到任意气体?从热力学第一定律的第一表达式和第二表达式来看,膨胀功和技 术功分别等于 w=q — u和wt=q —h,非理想气体的 3和Ah不一定等于 零,也不可能相等,所以理想气体定温过程的膨胀功等于技术功不能 推广到任意气体。11•下列三式的使用条件是什么?k 丄 k-1k k 丁 k-1 丁 k-1 丁 丁P2V2 =P1V1 , 1 1V1 =T 2V2 , I 1 P1 =T2 P2使用条件是:理想气体,可逆绝热过程。b-|||-a c-|||-v-|||-图 4-18-|||-p b-|||-丁.-|||-T。-|||-a-|||-O v-|||-图 4-18 题解4-13在p— v和T — s图上如何判断过程 q、w、厶u> h的正负。通过过程的起点划等容线(定容线),过程指向定容线右侧,系统 对外作功,w>0;过程指向定容线左侧,系统接收外功, w<0。通过过程的起点划等压线(定压线),过程指向定压线下侧,系统 对外输出技术功,wt>0;过程指向定压线上侧,系统接收外来技术功,wt<0。⏺通过过程的起点划等温线(定温线),过程指向定温线下侧,「山<0、.h<0 ;过程指向定温线上侧, u>0^ :h>0。⏺⏺吸收热量,q>0 ;过程指向定熵线左侧,4-14试以可逆绝热过程为例,说明水蒸气的热力过程与理想气体的热 力过程的分析计算有什么异同?相同点:都是首先确定起始状态和结束状态,然后在计算过程的 作功量等数据。计算过程中,始终要符合热力学第一定律。不同点:理想气体的计算是依靠理想气体状态方程以及功和热量 的积分计算式进行计算,而水蒸气是依靠查图查表进行计算。4-15实际过程都是不可逆的,那么本章讨论的理想可逆过程有什么意 义?理想可逆过程是对实际过程的近似和抽象,实际过程过于复杂不 易于分析,通过理想可逆过程的分析以及根据实际过程进行适当修正, 可以了解实际过程能量转换变化情况,以及如何向理想可逆过程靠近 以提高相应的技术指标。193页思考题 5-1 热力学第二定律能否表达为: “机械能可以全部变为热能,而热能 不可能全部变为机械能。 ”这种说法有什么不妥当?
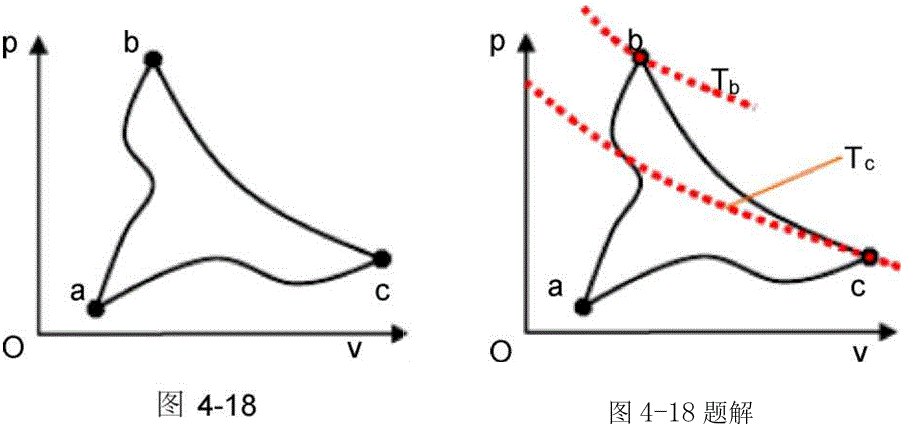 如图4-18所示,今有两个任意过程 a -b及a-C, b点及c点在同一 条绝热线上,(1)试问.-:Uab与.":Uac哪个大? (2)若b点及C点在同一条
如图4-18所示,今有两个任意过程 a -b及a-C, b点及c点在同一 条绝热线上,(1)试问.-:Uab与.":Uac哪个大? (2)若b点及C点在同一条
定温线上,结果又如何?
依题意,Tb>Tc,所以AUab>.;Uac。若b点及C点在同一条定温线上, 则匚 uab= ■: Uac°
10•理想气体定温过程的膨胀功等于技术功能否推广到任意气体?
从热力学第一定律的第一表达式和第二表达式来看,膨胀功和技 术功分别等于 w=q — u和wt=q —h,非理想气体的 3和Ah不一定等于 零,也不可能相等,所以理想气体定温过程的膨胀功等于技术功不能 推广到任意气体。
11•下列三式的使用条件是什么?
k 丄 k-1
k k 丁 k-1 丁 k-1 丁 丁
P2V2 =P1V1 , 1 1V1 =T 2V2 , I 1 P1 =T2 P2
使用条件是:理想气体,可逆绝热过程。
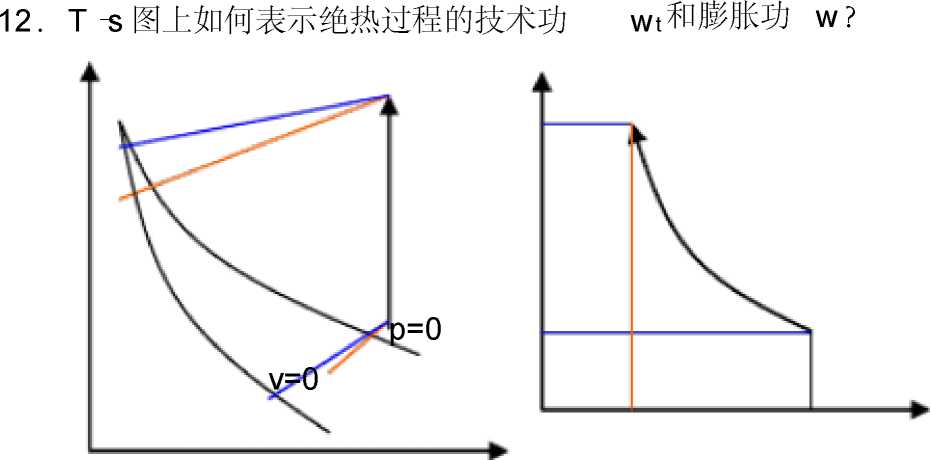
4-13在p— v和T — s图上如何判断过程 q、w、厶u> h的正负。
通过过程的起点划等容线(定容线),过程指向定容线右侧,系统 对外作功,w>0;过程指向定容线左侧,系统接收外功, w<0。
通过过程的起点划等压线(定压线),过程指向定压线下侧,系统 对外输出技术功,wt>0;过程指向定压线上侧,系统接收外来技术功,
wt<0。⏺
通过过程的起点划等温线(定温线),过程指向定温线下侧,「山<0、
.h<0 ;过程指向定温线上侧, u>0^ :h>0。
⏺
⏺
吸收热量,q>0 ;过程指向定熵线左侧,
4-14试以可逆绝热过程为例,说明水蒸气的热力过程与理想气体的热 力过程的分析计算有什么异同?
相同点:都是首先确定起始状态和结束状态,然后在计算过程的 作功量等数据。计算过程中,始终要符合热力学第一定律。
不同点:理想气体的计算是依靠理想气体状态方程以及功和热量 的积分计算式进行计算,而水蒸气是依靠查图查表进行计算。
4-15实际过程都是不可逆的,那么本章讨论的理想可逆过程有什么意 义?
理想可逆过程是对实际过程的近似和抽象,实际过程过于复杂不 易于分析,通过理想可逆过程的分析以及根据实际过程进行适当修正, 可以了解实际过程能量转换变化情况,以及如何向理想可逆过程靠近 以提高相应的技术指标。
193页思考题 5-1 热力学第二定律能否表达为: “机械能可以全部变为热能,而热能 不可能全部变为机械能。 ”这种说法有什么不妥当?
题目解答
答案
答:热能不是不可能全部变成机械能,如定温过程就可以。但想
要 连续地 将热能转变为机械能则是不可能的。
5-2 理想气体进行定温膨胀时, 可从单一恒温热源吸入的热量, 将之全 部转变为功对外输出,是否与热力学第二定律的开尔文叙述有矛盾? 提示:考虑气体本身是否有变化。
答:理想气体进行定温膨胀时,压力不断降低,体积越来越大。 当压力低到外界压力时,就不能再继续降低了,过程也就停止了。热 力学第二定律的开尔文叙述的内容是: 不可能制造出从单一热源吸热, 使之全部转化为功而不留下其他任何变化的热力发动机 ( 第二类永动 机是不可能制造成功的 。) 一方面压力降低,体积增大就是变化;另 一方面,热力发动机要求连续工作,而定温过程做不到。所以,这个 过程与热力学第二定律无矛盾。
5-3 自发过程是不可逆过程, 非自发过程必为可逆过程, 这一说法是否 正确?
答:错。“非自发过程必为可逆过程。 ”的说法完全错误,非自发 过程需付出代价(更强的自发过程)才能实现,可逆过程则是一种实 际上不存在的理想过程,两者之间没有什么关系。
工程热力学课后思考题答褰
第四版沈维道童铃耕主编高等教育出炭补
33页思考题
1闭口系与外界无物质交换,系统内质量保持恒定,那么系统内质量 保持恒定的热力系一定是闭口系统吗?
不一定,稳定流动系统内质量也保持恒定。
解析
考查要点:本题要求判断理想气体在不同热力过程中的内能变化大小,并理解定温过程与绝热过程的区别。
解题核心:
- 内能变化的判断:理想气体的内能仅是温度的函数(ΔU = nCvΔT)。
- 绝热线与定温线的性质:
- 绝热过程(Q=0)中,温度变化与过程路径有关。
- 定温过程(T=常数)中,ΔU = 0。
破题关键:通过比较b、c两点的温度关系,结合过程类型(绝热或定温)判断ΔU的大小。
第(1)题
已知条件:
- 过程a→b为任意过程,b点在绝热线上。
- 过程a→c为任意过程,c点在绝热线上。
- Tb > Tc(由题意隐含)。
分析:
- 绝热过程特性:绝热线上温度变化与过程方向有关。
- 内能变化公式:ΔU = nCvΔT。
- 比较ΔUab与ΔUac:
- a→b过程中,温度从Ta下降到Tb(因b在绝热线上,且Tb > Tc)。
- a→c过程中,温度从Ta下降到Tc(Tc < Tb)。
- 因ΔU与温度变化量成正比,故ΔUab > ΔUac。
第(2)题
已知条件:
- b、c两点在同一条定温线上(Tb = Tc)。
分析:
- 定温过程特性:ΔU = 0(温度不变)。
- 比较ΔUab与ΔUac:
- a→b过程中,温度从Ta下降到Tb(Tb = Tc)。
- a→c过程中,温度从Ta下降到Tc(Tc = Tb)。
- 两者温度变化量相同,故ΔUab = ΔUac。