10-13 设氢气的温度为300 ℃,求速率在 cdot (s)^-1 到 cdot (s)^-1 之间的分子数与-|||-速率在v0到 ((v)_(p)+10)mcdot (s)^-1 之间的分子数之比,其中v0为最概然速率.

题目解答
答案
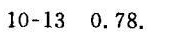
解析
本题考查麦克斯韦-玻耳兹曼速率分布的应用,核心在于比较两个不同速率区间内的分子数之比。解题关键点如下:
- 最概然速率的计算:需根据温度和分子质量计算最概然速率 $v_p = \sqrt{\frac{2kT}{m}}$,注意温度单位需转换为开尔文。
- 概率密度函数的比值:利用麦克斯韦分布公式,比较两个速率点处的概率密度,通过简化公式计算比值。
- 区间宽度的近似处理:由于速率区间宽度较小(均为 $10 \, \text{m/s}$),可用中间点的密度近似积分值,简化计算。
步骤1:计算最概然速率 $v_p$
氢气分子质量 $m = \frac{2 \times 10^{-3} \, \text{kg/mol}}{N_A} \approx 3.32 \times 10^{-27} \, \text{kg}$,温度 $T = 300^\circ \text{C} = 573.15 \, \text{K}$。
最概然速率公式为:
$v_p = \sqrt{\frac{2kT}{m}} = \sqrt{\frac{2 \cdot 1.38 \times 10^{-23} \cdot 573.15}{3.32 \times 10^{-27}}} \approx 2184 \, \text{m/s}.$
步骤2:计算概率密度比值
麦克斯韦分布的概率密度函数为:
$f(v) = 4\pi \left( \frac{m}{2\pi kT} \right)^{3/2} v^2 e^{-\frac{mv^2}{2kT}}.$
两速率区间分子数之比为:
$\frac{N(3000 \sim 3010)}{N(v_p \sim v_p + 10)} \approx \frac{f(3005)}{f(2189)} = \frac{(3005)^2 e^{-\frac{m(3005)^2}{2kT}}}{(2189)^2 e^{-\frac{m(2189)^2}{2kT}}}.$
步骤3:简化指数项
指数部分化简为:
$\exp\left[ -\frac{m}{2kT} \left( (3005)^2 - (2189)^2 \right) \right] \approx \exp(-0.887) \approx 0.411.$
代入计算得:
$\frac{(3005)^2}{(2189)^2} \cdot 0.411 \approx 1.884 \cdot 0.411 \approx 0.78.$