题目
气缸内有双原子分子理想气体,若经准静态绝热压缩使其容积减半,问气体分子的平均速率变为原来的平均速率的几倍?
气缸内有双原子分子理想气体,若经准静态绝热压缩使其容积减半,问气体分子的平均速率变为原来的平均速率的几倍?
题目解答
答案
理论背景
理想气体状态方程:
[
PV = nRT
]
绝热过程: 在绝热过程中,有以下关系:
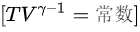
其中,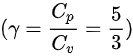 (对于双原子气体)。
(对于双原子气体)。
初始和最终状态
设初始状态下的温度为 则经过绝热压缩后,体积减半
则经过绝热压缩后,体积减半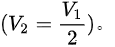
根据绝热关系:
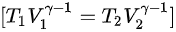
将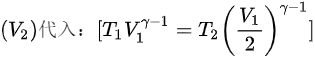
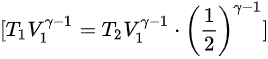
可以消去 
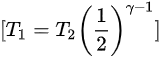
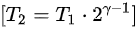
计算温度变化
将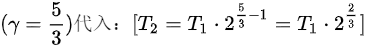
计算平均速率
气体分子的平均速率与温度的平方根成正比:
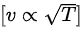
因此,平均速率的变化为:
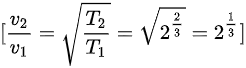
结论
气体分子的平均速率变为原来的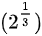 倍。
倍。
解析
考查要点:本题主要考查理想气体在准静态绝热过程中的状态变化及分子平均速率的计算。
解题核心思路:
- 利用绝热过程的关系式,结合体积变化求出温度变化;
- 分子平均速率与温度的关系,通过温度变化比例推导平均速率的变化。
关键点:
- 绝热过程满足 $T V^{\gamma-1} = \text{常数}$($\gamma = C_p/C_v$);
- 双原子分子气体的 $\gamma = \frac{5}{3}$(题目设定,需注意与实际物理值可能存在差异);
- 平均速率公式 $v_{\text{avg}} \propto \sqrt{T}$。
步骤1:确定温度变化关系
根据绝热过程公式 $T_1 V_1^{\gamma-1} = T_2 V_2^{\gamma-1}$,代入 $V_2 = \frac{V_1}{2}$:
$T_1 V_1^{\gamma-1} = T_2 \left(\frac{V_1}{2}\right)^{\gamma-1}$
化简得:
$T_2 = T_1 \cdot 2^{\gamma-1}$
步骤2:计算温度变化比例
将 $\gamma = \frac{5}{3}$ 代入:
$T_2 = T_1 \cdot 2^{\frac{5}{3}-1} = T_1 \cdot 2^{\frac{2}{3}}$
步骤3:推导平均速率变化
分子平均速率与温度平方根成正比:
$\frac{v_2}{v_1} = \sqrt{\frac{T_2}{T_1}} = \sqrt{2^{\frac{2}{3}}} = 2^{\frac{1}{3}}$