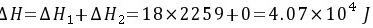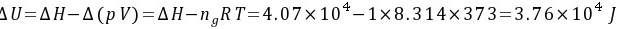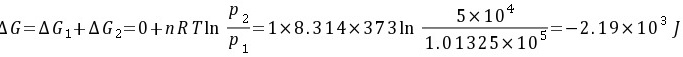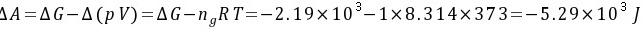第二章 热力学第二定律习题5 10g H2(假设为理想气体)在27°C、5 × 105 Pa时,在保持温度为27°C恒定外压为106 Pa下进行压缩,终态压力为106 Pa(需注意此过程为不可逆过程),试求算此过程的S,并与实际过程的热温商比较。P61[答案:-28.8 J·K-1;-41.6 J·K-1]
第二章 热力学第二定律
习题5 10g H2(假设为理想气体)在27°C、5 × 105 Pa时,在保持温度为27°C恒定外压为106 Pa下进行压缩,终态压力为106 Pa(需注意此过程为不可逆过程),试求算此过程的S,并与实际过程的热温商比较。P61
[答案:-28.8 J·K-1;-41.6 J·K-1]
题目解答
答案
解:因为是理想气体的定温过程,所以有
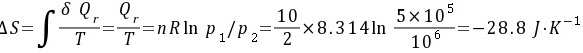
又因为
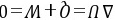
所以
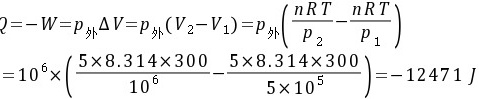
因此该过程的热温商为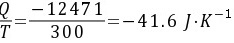 因为
因为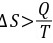
所以该过程为不可逆过程。
习题11 1 mol He(假设为理想气体)其始态为V1 = 22.4 dm3,T1 = 273 K,经由一任意变化到达终态为p2 = 2 × 105 Pa,T2 = 303 K。试计算此过程中系统的S。P64 [答案:-3.48 J·K-1]
解:p1=nRT1/V1=(8.314×273/(22.4×10-3))Pa=1.103×105Pa
∆S=nCp,mln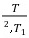 -nRln
-nRln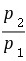 =1mol×(
=1mol×(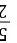 Rln
Rln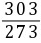 -Rln
-Rln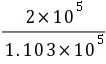 )=-3.48 J·K-1
)=-3.48 J·K-1
习题12 2 mol某单原子分子理想气体其始态为105 Pa,273 K,经过一绝热压缩过程至终态为4 × 105 Pa,546 K。试求算S,并判断此绝热过程是否为可逆。
P64 [答案:5.76 J·K-1]
解:该过程可分解为如下两步:
(1) 由105 Pa,273 K定温压缩至4 × 105 Pa,273 K;
(2) 由4 × 105 Pa,273 K定压升温至4 × 105 Pa,546 K。
这两步的熵变分别为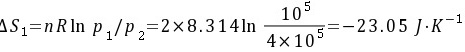
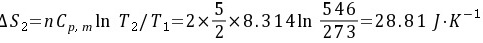 所以整个过程的熵变为
所以整个过程的熵变为
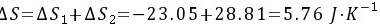 又因为实际过程为绝热过程,所以其热温商为
又因为实际过程为绝热过程,所以其热温商为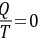 所以
所以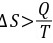 因此该过程为不可逆过程。
因此该过程为不可逆过程。
注:求算S时,也可以直接使用习题 10的公式(2)进行计算。
习题18 试计算−10°C、标准压力下,1 mol的过冷水变成冰这一过程的S,并与实际过程的热温商比较以判断此过程是否自发。已知水和冰的热容分别为4.184和2.092 J·K−1·g−1,0°C时冰的熔化热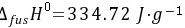 。P66
。P66
[答案:-20.7 J·K-1·mol-1]
解:从始态到终态设计如下可逆过程:
(1) 标准压力下,−10°C的1 mol水可逆加热至0°C;
(2)标准压力下,1 mol 0°C的水凝固成0°C的冰;
(3) 标准压力下,1 mol 0°C的冰可逆冷却至−10°C。
这三个步骤的熵变分别为:
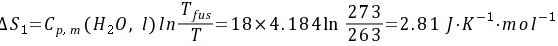
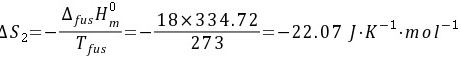
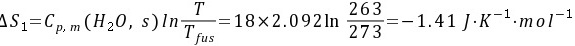
所以实际过程的熵变为
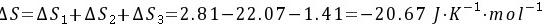
又该实际过程的热效应为
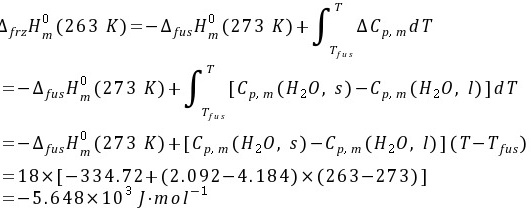
所以实际过程的热温商为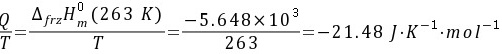 因为
因为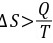 所以该过程为自发过程。
所以该过程为自发过程。
习题23 试证明(1)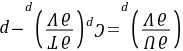
证明:方法1:因为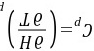 所以
所以
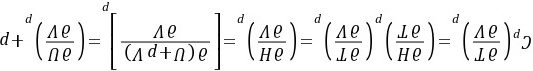
即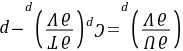
方法2:因为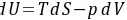 在定压条件下将上式两端同除以dV,得到
在定压条件下将上式两端同除以dV,得到
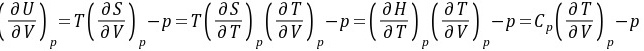
得证。
(2)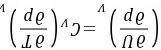
证明:方法1: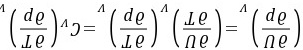
方法2:因为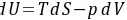 在定容条件下将上式两端同除以dp,得到
在定容条件下将上式两端同除以dp,得到
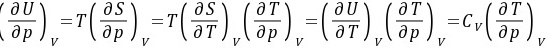 得证。
得证。
总结:如果等式中含有相同自变量的偏微商,可首先考虑应用复合函数的偏微商公式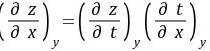 进行代换。
进行代换。
习题28 设有300 K的1 mol理想气体作定温膨胀,起始压力为1 × 106 Pa,终态体积为10 dm3。试计算此过程的ΔU、ΔH、ΔS、ΔA和ΔG。P77
[答案:ΔU=ΔH=0;ΔS=14.9J·K-1;ΔA=ΔG=-4.47×103J]
解:终态压力为
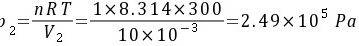
因为是理想气体的定温过程,所以有
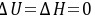
∆S=nRTln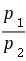 =1×8.314×ln
=1×8.314×ln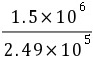 =14.9J·K-1
=14.9J·K-1
∆A=∆U-T∆S=-T∆S =-300×14.9=-4.47×103J
∆A=∆H-T∆S=-T∆S=-300×14.9=-4.47×103J
习题32 已知水在100°C及标准压力下的蒸发热为2259 J·g−1,求1 mol 100°C及标准压力的水蒸发为100°C、5 × 104 Pa的水蒸气的U、H、A和G。P79 [答案:3.76×104,4.07×104,-5.25×103,-2.15×103J]
解:该蒸发过程可以分为以下两步:
(1) 1 mol 100°C及标准压力的水蒸发100°C及标准压力的水蒸气;
(2) 1 mol 100°C及标准压力的水蒸气定温膨胀至5 × 104 Pa。
若把水蒸气看作是理想气体,则有