题目
10.8 3 mol氧气在压强为2 atm时体积为40L,先将它绝热压缩到一半体积,接着再-|||-令它等温膨胀到原体积。-|||-(1)求这一过程的最大压强和最高温度;-|||-(2)求这一过程中氧气吸收的热量、对外做的功以及内能的变化;-|||-(3)在 -v 图上画出整个过程曲线。

题目解答
答案
解析
步骤 1:确定绝热过程的终态压强和温度
根据绝热过程的方程 ${pV^\gamma} = \text{常数}$,其中 $\gamma = \frac{C_p}{C_v} = \frac{7}{5}$ 对于氧气,我们有:
${p_2} = {p_1}{\left(\frac{{V_1}}{{V_2}}\right)^\gamma} = 2 \times {\left(\frac{40}{20}\right)^{1.4}} = 5.28 \text{ atm}$
${T_2} = \frac{{p_2V_2}}{{nR}} = \frac{5.28 \times 1.013 \times 10^5 \times 20 \times 10^{-3}}{3 \times 8.31} = 429 \text{ K}$
步骤 2:计算等温膨胀过程中的功
等温膨胀过程中,根据理想气体状态方程,${pV} = \text{常数}$,所以:
$W = nRT_2 \ln \frac{{V_1}}{{V_2}} = 3 \times 8.31 \times 429 \times \ln \frac{40}{20} = 7.41 \times 10^3 \text{ J}$
步骤 3:计算整个过程中的热量、功和内能变化
由于绝热过程没有热量交换,所以整个过程中的热量 $Q = 0$。
整个过程中的功 $A = W = 7.41 \times 10^3 \text{ J}$。
内能变化 $\Delta E = Q - A = 0 - 7.41 \times 10^3 = -7.41 \times 10^3 \text{ J}$
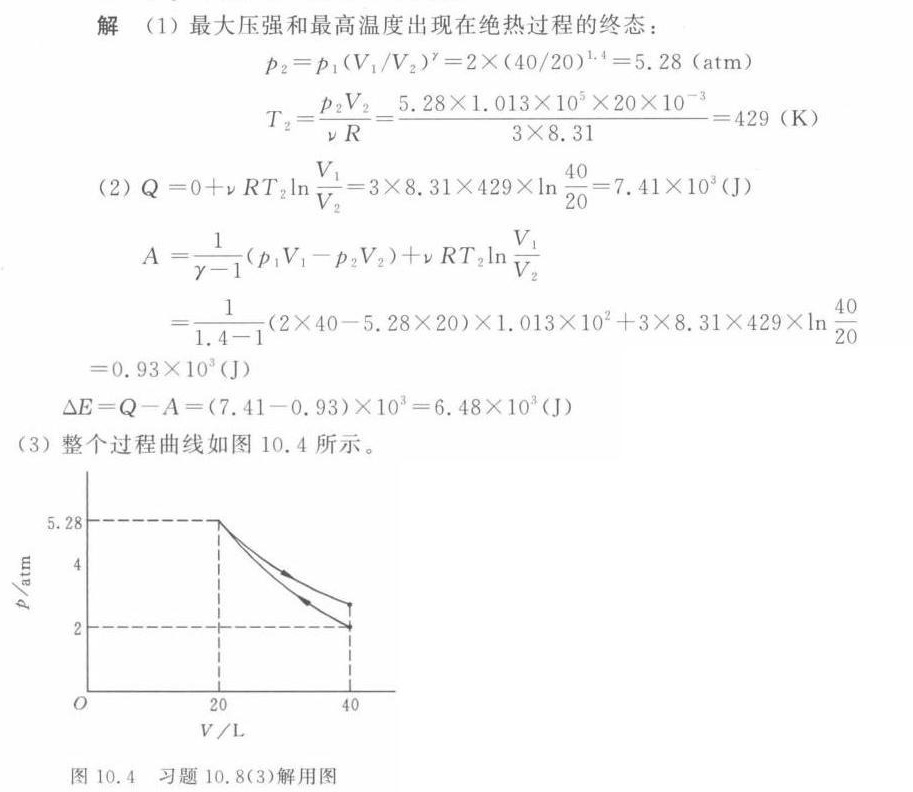
步骤 4:绘制 $P-V$ 图
在 $P-V$ 图上,绝热过程是一条从 $(p_1, V_1)$ 到 $(p_2, V_2)$ 的曲线,等温过程是一条从 $(p_2, V_2)$ 到 $(p_3, V_1)$ 的曲线,其中 $p_3 = p_1$。
根据绝热过程的方程 ${pV^\gamma} = \text{常数}$,其中 $\gamma = \frac{C_p}{C_v} = \frac{7}{5}$ 对于氧气,我们有:
${p_2} = {p_1}{\left(\frac{{V_1}}{{V_2}}\right)^\gamma} = 2 \times {\left(\frac{40}{20}\right)^{1.4}} = 5.28 \text{ atm}$
${T_2} = \frac{{p_2V_2}}{{nR}} = \frac{5.28 \times 1.013 \times 10^5 \times 20 \times 10^{-3}}{3 \times 8.31} = 429 \text{ K}$
步骤 2:计算等温膨胀过程中的功
等温膨胀过程中,根据理想气体状态方程,${pV} = \text{常数}$,所以:
$W = nRT_2 \ln \frac{{V_1}}{{V_2}} = 3 \times 8.31 \times 429 \times \ln \frac{40}{20} = 7.41 \times 10^3 \text{ J}$
步骤 3:计算整个过程中的热量、功和内能变化
由于绝热过程没有热量交换,所以整个过程中的热量 $Q = 0$。
整个过程中的功 $A = W = 7.41 \times 10^3 \text{ J}$。
内能变化 $\Delta E = Q - A = 0 - 7.41 \times 10^3 = -7.41 \times 10^3 \text{ J}$
步骤 4:绘制 $P-V$ 图
在 $P-V$ 图上,绝热过程是一条从 $(p_1, V_1)$ 到 $(p_2, V_2)$ 的曲线,等温过程是一条从 $(p_2, V_2)$ 到 $(p_3, V_1)$ 的曲线,其中 $p_3 = p_1$。