题目
硫酸工业在国民经济中占有极其重要的地位。如图是工业制硫酸的生产流程示意图,读图后回答下列小题。98.3%-|||-了 H2SO4 尾气-|||-经净化 催化剂-|||-黄铁矿 SO2,O2 催化剂 SO2,O2-|||-矿 渣 供稀释-|||-空气 文 用硫酸-|||-SO3-|||-沸腾炉 转化器 吸收塔(1)将燃烧黄铁矿的化学方程式补充完整:4 ____ +11O2(underline(;高温;))/(;)2Fe2O3+8SO2。(2)转化是工业制硫酸的重要一步,即SO2和空气的混合物通过转化器反应生成SO3,实际生产中,反应温度选定在475℃左右。①写出转化器中发生反应的化学方程式是 ____ 。②反应温度选在475℃左右的依据是 ____ 。③工业上是如何加热原料气的? ____ 。这样设计的好处是什么? ____ 。(3)依据工艺流程图判断下列说法错误的是 ____ 。A.为使黄铁矿充分燃烧,需将其粉碎B.过量空气能提高SO2的转化率C.使用催化剂能提高SO2的反应速率和转化率D.沸腾炉排出的矿渣可供炼铁(4)工业制硫酸的工艺中,通常用来吸收尾气的物质是 ____ 。A.氨水B.硫酸C.氯化钙D.氢硫酸(5)下列说法错误的是 ____ 。A.化学反应速率理论是研究怎样在一定时间内加快产品的生产B.化学平衡理论是研究怎样使用有限原料提高产品的产量C.化学反应速率理论是研究怎样提高原料的转化率D.化工生产要坚持绿色环保的生产方式,实现可持续发展(6)关于工业制硫酸的错误的叙述是 ____ 。A.沸腾炉外设置废热锅炉回收高温废热B.氨酸法是用氨水吸收尾气中的SO2,产物NH4HSO3再用硫酸处理C.制酸厂若排出的是酸性废水,一般用石灰乳等中和处理D.硫酸工厂可以建在人口稠密的居民区(7)在硫酸的工业生产中,下列生产操作及其原因解释二者都正确的是 ____ 。①硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧;②SO2氧化为SO3时需要高压,这样可以提高SO2的转化率;③SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率;④用98.3%的浓H2SO4吸收SO3,可以防止形成酸雾阻碍SO3的吸收。A.①②B.②③C.仅④D.③④
硫酸工业在国民经济中占有极其重要的地位。如图是工业制硫酸的生产流程示意图,读图后回答下列小题。
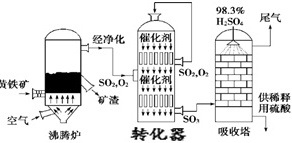
(1)将燃烧黄铁矿的化学方程式补充完整:4 ____ +11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2。
(2)转化是工业制硫酸的重要一步,即SO2和空气的混合物通过转化器反应生成SO3,实际生产中,反应温度选定在475℃左右。
①写出转化器中发生反应的化学方程式是 ____ 。
②反应温度选在475℃左右的依据是 ____ 。
③工业上是如何加热原料气的? ____ 。这样设计的好处是什么? ____ 。
(3)依据工艺流程图判断下列说法错误的是 ____ 。
A.为使黄铁矿充分燃烧,需将其粉碎
B.过量空气能提高SO2的转化率
C.使用催化剂能提高SO2的反应速率和转化率
D.沸腾炉排出的矿渣可供炼铁
(4)工业制硫酸的工艺中,通常用来吸收尾气的物质是 ____ 。
A.氨水
B.硫酸
C.氯化钙
D.氢硫酸
(5)下列说法错误的是 ____ 。
A.化学反应速率理论是研究怎样在一定时间内加快产品的生产
B.化学平衡理论是研究怎样使用有限原料提高产品的产量
C.化学反应速率理论是研究怎样提高原料的转化率
D.化工生产要坚持绿色环保的生产方式,实现可持续发展
(6)关于工业制硫酸的错误的叙述是 ____ 。
A.沸腾炉外设置废热锅炉回收高温废热
B.氨酸法是用氨水吸收尾气中的SO2,产物NH4HSO3再用硫酸处理
C.制酸厂若排出的是酸性废水,一般用石灰乳等中和处理
D.硫酸工厂可以建在人口稠密的居民区
(7)在硫酸的工业生产中,下列生产操作及其原因解释二者都正确的是 ____ 。
①硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧;
②SO2氧化为SO3时需要高压,这样可以提高SO2的转化率;
③SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率;
④用98.3%的浓H2SO4吸收SO3,可以防止形成酸雾阻碍SO3的吸收。
A.①②
B.②③
C.仅④
D.③④

(1)将燃烧黄铁矿的化学方程式补充完整:4 ____ +11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2。
(2)转化是工业制硫酸的重要一步,即SO2和空气的混合物通过转化器反应生成SO3,实际生产中,反应温度选定在475℃左右。
①写出转化器中发生反应的化学方程式是 ____ 。
②反应温度选在475℃左右的依据是 ____ 。
③工业上是如何加热原料气的? ____ 。这样设计的好处是什么? ____ 。
(3)依据工艺流程图判断下列说法错误的是 ____ 。
A.为使黄铁矿充分燃烧,需将其粉碎
B.过量空气能提高SO2的转化率
C.使用催化剂能提高SO2的反应速率和转化率
D.沸腾炉排出的矿渣可供炼铁
(4)工业制硫酸的工艺中,通常用来吸收尾气的物质是 ____ 。
A.氨水
B.硫酸
C.氯化钙
D.氢硫酸
(5)下列说法错误的是 ____ 。
A.化学反应速率理论是研究怎样在一定时间内加快产品的生产
B.化学平衡理论是研究怎样使用有限原料提高产品的产量
C.化学反应速率理论是研究怎样提高原料的转化率
D.化工生产要坚持绿色环保的生产方式,实现可持续发展
(6)关于工业制硫酸的错误的叙述是 ____ 。
A.沸腾炉外设置废热锅炉回收高温废热
B.氨酸法是用氨水吸收尾气中的SO2,产物NH4HSO3再用硫酸处理
C.制酸厂若排出的是酸性废水,一般用石灰乳等中和处理
D.硫酸工厂可以建在人口稠密的居民区
(7)在硫酸的工业生产中,下列生产操作及其原因解释二者都正确的是 ____ 。
①硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧;
②SO2氧化为SO3时需要高压,这样可以提高SO2的转化率;
③SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率;
④用98.3%的浓H2SO4吸收SO3,可以防止形成酸雾阻碍SO3的吸收。
A.①②
B.②③
C.仅④
D.③④
题目解答
答案
解:(1)燃烧黄铁矿生成氧化铁、二氧化硫,反应为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
故答案为:FeS2;
(2)①转化器中发生反应二氧化硫和氧气在催化剂作用下加热生成三氧化硫,2SO2+O2$⇌_{△}^{催化剂}$2SO3,
故答案为:2SO2+O2$⇌_{△}^{催化剂}$2SO3;
②反应温度选在475℃左右的依据是此时催化剂活性最高,对反应的催化效率最好,
故答案为:反应温度控制在475℃左右,催化剂活性最大,反应速率较大;
③工业上通过转化器中的热交换器使用反应放出的热量来加热原料气,这样设计的好处是可以充分利于反应放出的热量,节约能源,
故答案为:通过转化器中的热交换器使用反应放出的热量;可以充分利于反应放出的热量,节约能源;
(3)A.黄铁矿粉碎可以增大与反应物的接触面积,加快反应速率,故A正确;
B.过量空气能促使反应向生成三氧化硫的方向移动,提高SO2的转化率,故正确;
C.使用催化剂能提高SO2的反应速率,但是不能改变反应中物质的平衡转化率,故C错误;
D.沸腾炉排出的矿渣中含有铁元素,可供炼铁,故D正确;
故答案为:C;
(4)工业制硫酸的工艺中尾气含有硫的氧化物,硫酸、氯化钙不能和其反应,硫化氢溶解度较小吸收效果不好,氨气极易溶于水得到碱性物质氨水,故可以使用碱液氨水吸收;
故答案为:A;
(5)A.化学反应速率理论是研究提高反应的速率,怎样在一定时间内加快产品的生产,故A正确;
B.化学平衡理论是研究提高原料的转化率,怎样使用有限原料提高产品的产量,故B正确;
C.化学反应速率理论是是研究提高反应的速率,故C错误;
D.化工生产要坚持绿色环保的生产方式,减少对环境的污染,实现可持续发展,故D正确;
故答案为:C;
(6)A.沸腾炉外设置废热锅炉回收高温废热,充分利用能源,故A正确;
B.氨酸法是用氨水吸收尾气中的SO2,产物NH4HSO3再用硫酸处理再生成二氧化硫,循环利用,故B正确;
C.制酸厂若排出的是酸性废水,一般用石灰乳等中和处理后排放,防止污染环境,故C正确;
D.硫酸工厂污染性大、对环境有影响,不可以建在人口稠密的居民区,故D错误;
故答案为:D;
(7)①硫铁矿燃烧前需要粉碎,是增大与反应物的接触面积,加快反应速率,故①错误;
②SO2氧化为SO3反应常压下转化率已经很高,高压对SO2的转化率影响不大,故②错误;
③SO2氧化为SO3时需要使用催化剂,这样可以加快反应速率,但是不能提高SO2的转化率,故③错误;
④用98.3%的浓H2SO4吸收SO3,可以防止形成酸雾阻碍SO3的吸收,从而提高吸收效率,故④正确;
故答案为:C。
故答案为:FeS2;
(2)①转化器中发生反应二氧化硫和氧气在催化剂作用下加热生成三氧化硫,2SO2+O2$⇌_{△}^{催化剂}$2SO3,
故答案为:2SO2+O2$⇌_{△}^{催化剂}$2SO3;
②反应温度选在475℃左右的依据是此时催化剂活性最高,对反应的催化效率最好,
故答案为:反应温度控制在475℃左右,催化剂活性最大,反应速率较大;
③工业上通过转化器中的热交换器使用反应放出的热量来加热原料气,这样设计的好处是可以充分利于反应放出的热量,节约能源,
故答案为:通过转化器中的热交换器使用反应放出的热量;可以充分利于反应放出的热量,节约能源;
(3)A.黄铁矿粉碎可以增大与反应物的接触面积,加快反应速率,故A正确;
B.过量空气能促使反应向生成三氧化硫的方向移动,提高SO2的转化率,故正确;
C.使用催化剂能提高SO2的反应速率,但是不能改变反应中物质的平衡转化率,故C错误;
D.沸腾炉排出的矿渣中含有铁元素,可供炼铁,故D正确;
故答案为:C;
(4)工业制硫酸的工艺中尾气含有硫的氧化物,硫酸、氯化钙不能和其反应,硫化氢溶解度较小吸收效果不好,氨气极易溶于水得到碱性物质氨水,故可以使用碱液氨水吸收;
故答案为:A;
(5)A.化学反应速率理论是研究提高反应的速率,怎样在一定时间内加快产品的生产,故A正确;
B.化学平衡理论是研究提高原料的转化率,怎样使用有限原料提高产品的产量,故B正确;
C.化学反应速率理论是是研究提高反应的速率,故C错误;
D.化工生产要坚持绿色环保的生产方式,减少对环境的污染,实现可持续发展,故D正确;
故答案为:C;
(6)A.沸腾炉外设置废热锅炉回收高温废热,充分利用能源,故A正确;
B.氨酸法是用氨水吸收尾气中的SO2,产物NH4HSO3再用硫酸处理再生成二氧化硫,循环利用,故B正确;
C.制酸厂若排出的是酸性废水,一般用石灰乳等中和处理后排放,防止污染环境,故C正确;
D.硫酸工厂污染性大、对环境有影响,不可以建在人口稠密的居民区,故D错误;
故答案为:D;
(7)①硫铁矿燃烧前需要粉碎,是增大与反应物的接触面积,加快反应速率,故①错误;
②SO2氧化为SO3反应常压下转化率已经很高,高压对SO2的转化率影响不大,故②错误;
③SO2氧化为SO3时需要使用催化剂,这样可以加快反应速率,但是不能提高SO2的转化率,故③错误;
④用98.3%的浓H2SO4吸收SO3,可以防止形成酸雾阻碍SO3的吸收,从而提高吸收效率,故④正确;
故答案为:C。