题目
5.已知: (HAC)=1.75times (10)^-5 则 .1molcdot (L)^-1 的NaAc溶液中的 ((H)^+)= __ 其-|||-= __ 。
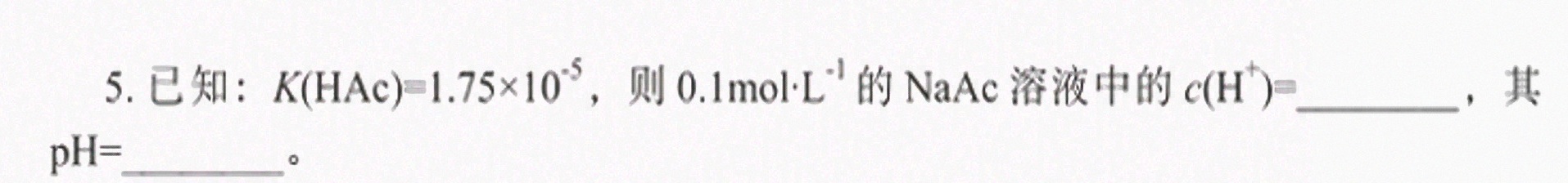
题目解答
答案
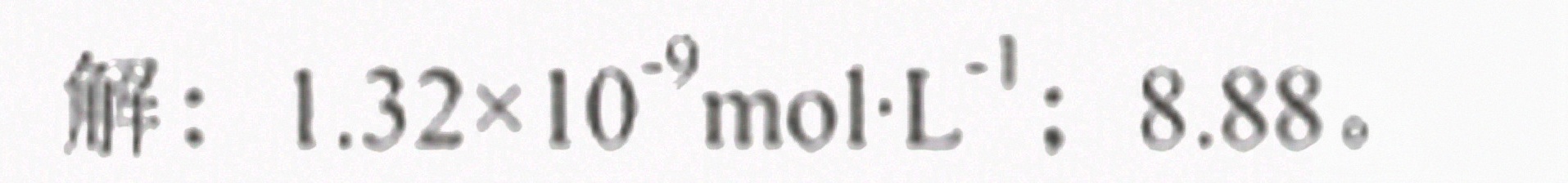
解析
步骤 1:确定醋酸钠(NaAc)的水解反应
醋酸钠(NaAc)在水中会水解生成醋酸(HAc)和氢氧根离子(OH⁻)。水解反应可以表示为:$NaAc + H_2O \rightleftharpoons HAc + NaOH$。由于醋酸(HAc)是弱酸,其水解反应会生成氢离子(H⁺)和醋酸根离子(Ac⁻)。
步骤 2:计算醋酸根离子(Ac⁻)的水解常数
醋酸根离子(Ac⁻)的水解常数($K_b$)可以通过醋酸(HAc)的酸解离常数($K_a$)计算得到。$K_b = \frac{K_w}{K_a}$,其中 $K_w$ 是水的离子积常数,等于 $1.0 \times 10^{-14}$。因此,$K_b = \frac{1.0 \times 10^{-14}}{1.75 \times 10^{-5}} = 5.71 \times 10^{-10}$。
步骤 3:计算氢离子浓度($c(H^+)$)
由于醋酸钠(NaAc)的浓度为 $0.1 mol \cdot L^{-1}$,我们可以假设水解产生的氢离子(H⁺)浓度为 $x$。根据水解反应,$c(H^+) = x$,$c(OH^-) = x$,$c(Ac^-) = 0.1 - x$。由于 $x$ 相对较小,可以近似认为 $c(Ac^-) = 0.1$。因此,$K_b = \frac{x^2}{0.1}$,解得 $x = \sqrt{0.1 \times 5.71 \times 10^{-10}} = 1.32 \times 10^{-9} mol \cdot L^{-1}$。
步骤 4:计算pH值
pH值可以通过氢离子浓度($c(H^+)$)计算得到。$pH = -\log(c(H^+)) = -\log(1.32 \times 10^{-9}) = 8.88$。
醋酸钠(NaAc)在水中会水解生成醋酸(HAc)和氢氧根离子(OH⁻)。水解反应可以表示为:$NaAc + H_2O \rightleftharpoons HAc + NaOH$。由于醋酸(HAc)是弱酸,其水解反应会生成氢离子(H⁺)和醋酸根离子(Ac⁻)。
步骤 2:计算醋酸根离子(Ac⁻)的水解常数
醋酸根离子(Ac⁻)的水解常数($K_b$)可以通过醋酸(HAc)的酸解离常数($K_a$)计算得到。$K_b = \frac{K_w}{K_a}$,其中 $K_w$ 是水的离子积常数,等于 $1.0 \times 10^{-14}$。因此,$K_b = \frac{1.0 \times 10^{-14}}{1.75 \times 10^{-5}} = 5.71 \times 10^{-10}$。
步骤 3:计算氢离子浓度($c(H^+)$)
由于醋酸钠(NaAc)的浓度为 $0.1 mol \cdot L^{-1}$,我们可以假设水解产生的氢离子(H⁺)浓度为 $x$。根据水解反应,$c(H^+) = x$,$c(OH^-) = x$,$c(Ac^-) = 0.1 - x$。由于 $x$ 相对较小,可以近似认为 $c(Ac^-) = 0.1$。因此,$K_b = \frac{x^2}{0.1}$,解得 $x = \sqrt{0.1 \times 5.71 \times 10^{-10}} = 1.32 \times 10^{-9} mol \cdot L^{-1}$。
步骤 4:计算pH值
pH值可以通过氢离子浓度($c(H^+)$)计算得到。$pH = -\log(c(H^+)) = -\log(1.32 \times 10^{-9}) = 8.88$。