题目
工业上利用石煤矿粉(主要含V2O3及少量Al2O3、SiO2)为原料生产V2O5,工艺流程如图:NaCl(8)气体1 水 Ca(OH)2(NH4)2CO3 NH4Cl 气体Ⅱ-|||-而煤矿粉→ 嬉烧 → 水浴 → 转沉 → 转化 沉闪 → 脱远 --------2:O3-|||-O,水蒸气 滤渣I 滤液1 滤渣Ⅱ 滤液Ⅱ已知:①“水溶”、“转沉”、“转化”后,所得含钒物质依次为NaVO3、Ca4(VO4)2、(NH4)3VO4;②不同pH下,V(V)在溶液中的主要存在形式见下表: pH 4~6 6~8 8~10 10~12 主要离子 VO2+ VO3- V2O74- VO43- ③25℃时,Kap(NH4VO3)=1.6×10-3。回答下列问题:(1)‘焙烧”时,V2O3发生反应的化学方程式为 ____ 。(2)滤液Ⅰ的成分为 ____ (填化学式);先“转沉”后“转化”的目的是 ____ 。(3)“转化”时,滤渣Ⅱ经高温煅烧后水浸,所得物质可导入到 ____ 操作单元中循环使用。(4)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是① ____ 。② ____ ;25℃时,测得“转化”后,滤液中c(VO3-)=0.2mol•L-1,为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中c(NH4+)至少 ____ mol•L-1。(5)“煅烧”时,NH4VO3制得产品V2O5。但反应体系中,若不及时分离气体Ⅱ,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为 ____ 。
工业上利用石煤矿粉(主要含V2O3及少量Al2O3、SiO2)为原料生产V2O5,工艺流程如图:
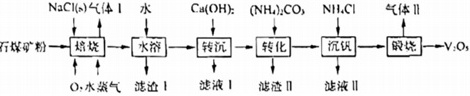
已知:①“水溶”、“转沉”、“转化”后,所得含钒物质依次为NaVO3、Ca4(VO4)2、(NH4)3VO4;
②不同pH下,V(V)在溶液中的主要存在形式见下表:
③25℃时,Kap(NH4VO3)=1.6×10-3。
回答下列问题:
(1)‘焙烧”时,V2O3发生反应的化学方程式为 ____ 。
(2)滤液Ⅰ的成分为 ____ (填化学式);先“转沉”后“转化”的目的是 ____ 。
(3)“转化”时,滤渣Ⅱ经高温煅烧后水浸,所得物质可导入到 ____ 操作单元中循环使用。
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是① ____ 。② ____ ;25℃时,测得“转化”后,滤液中c(VO3-)=0.2mol•L-1,为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中c(NH4+)至少 ____ mol•L-1。
(5)“煅烧”时,NH4VO3制得产品V2O5。但反应体系中,若不及时分离气体Ⅱ,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为 ____ 。

已知:①“水溶”、“转沉”、“转化”后,所得含钒物质依次为NaVO3、Ca4(VO4)2、(NH4)3VO4;
②不同pH下,V(V)在溶液中的主要存在形式见下表:
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO2+ | VO3- | V2O74- | VO43- |
回答下列问题:
(1)‘焙烧”时,V2O3发生反应的化学方程式为 ____ 。
(2)滤液Ⅰ的成分为 ____ (填化学式);先“转沉”后“转化”的目的是 ____ 。
(3)“转化”时,滤渣Ⅱ经高温煅烧后水浸,所得物质可导入到 ____ 操作单元中循环使用。
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是① ____ 。② ____ ;25℃时,测得“转化”后,滤液中c(VO3-)=0.2mol•L-1,为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中c(NH4+)至少 ____ mol•L-1。
(5)“煅烧”时,NH4VO3制得产品V2O5。但反应体系中,若不及时分离气体Ⅱ,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为 ____ 。
题目解答
答案
解:(1)V2O3与氧气、氯化钠混合中煅烧,转化为NaVO3的过程中V元素被氧气氧化,根据电子守恒和元素守恒可得化学方程式为V2O3+O2+2NaCl+H2O$\frac{\underline{\;高温\;}}{\;}$2NaVO3+2HCl,
故答案为:V2O3+O2+2NaCl+H2O$\frac{\underline{\;高温\;}}{\;}$2NaVO3+2HCl;
(2)根据复分解反应交换成分可知,硅酸钠和氢氧化钙反应生成Ca(SiO3)2沉淀和NaOH,故滤液为NaOH,先“转沉”后“转化”的目的是富集钒元素,
故答案为:NaOH;富集钒元素;
(3)滤渣Ⅱ是煅烧生成CaO,与水反应生成氢氧化钙,可到转沉中循环使用,
故答案为:转沉;
(4)沉钒过程发生复分解反应,离子方程式为NH4++VO3-=NH4VO3↓,利用同离子效应,促进NH4VO3尽可能析出完全,铵根离子先酸性,调节pH,将$VO_4^{3-}$转化为$VO_3^-$,已知:Ksp(NH4VO3)=1.6×10-3,若滤液中c(VO3-)=0.2mol•L-1,为使钒元素的沉降率达到96%,则此时c(VO3-)=0.008mol/L,至少应调节c(NH4+)=$\frac{{K}_{\;sp}}{c(VO{}_{3}{}^{−})}$=$\frac{1.6×10{}^{−3}}{0.008}$mol/L=0.2mol/L,
故答案为:①调节pH,将$VO_4^{3-}$转化为$VO_3^-$;②利用同离子效应,促进NH4VO3尽可能析出完全;0.2;
(5)反应中氧化剂与还原剂物质的量之比为3:2,设氧化产物中N元素化合价为x,根据转移电子守恒得3×2×(5-4)=2×[x-(-3)],则x=0,所以氧化产物为氮气,根据元素守恒知,还生成水,所以反应方程式为3V2O5+2NH3$\frac{\underline{\;500℃\;}}{}$3V2O4+N2+3H2O,
故答案为:3V2O5+2NH3$\frac{\underline{\;500℃\;}}{}$3V2O4+N2+3H2O。
故答案为:V2O3+O2+2NaCl+H2O$\frac{\underline{\;高温\;}}{\;}$2NaVO3+2HCl;
(2)根据复分解反应交换成分可知,硅酸钠和氢氧化钙反应生成Ca(SiO3)2沉淀和NaOH,故滤液为NaOH,先“转沉”后“转化”的目的是富集钒元素,
故答案为:NaOH;富集钒元素;
(3)滤渣Ⅱ是煅烧生成CaO,与水反应生成氢氧化钙,可到转沉中循环使用,
故答案为:转沉;
(4)沉钒过程发生复分解反应,离子方程式为NH4++VO3-=NH4VO3↓,利用同离子效应,促进NH4VO3尽可能析出完全,铵根离子先酸性,调节pH,将$VO_4^{3-}$转化为$VO_3^-$,已知:Ksp(NH4VO3)=1.6×10-3,若滤液中c(VO3-)=0.2mol•L-1,为使钒元素的沉降率达到96%,则此时c(VO3-)=0.008mol/L,至少应调节c(NH4+)=$\frac{{K}_{\;sp}}{c(VO{}_{3}{}^{−})}$=$\frac{1.6×10{}^{−3}}{0.008}$mol/L=0.2mol/L,
故答案为:①调节pH,将$VO_4^{3-}$转化为$VO_3^-$;②利用同离子效应,促进NH4VO3尽可能析出完全;0.2;
(5)反应中氧化剂与还原剂物质的量之比为3:2,设氧化产物中N元素化合价为x,根据转移电子守恒得3×2×(5-4)=2×[x-(-3)],则x=0,所以氧化产物为氮气,根据元素守恒知,还生成水,所以反应方程式为3V2O5+2NH3$\frac{\underline{\;500℃\;}}{}$3V2O4+N2+3H2O,
故答案为:3V2O5+2NH3$\frac{\underline{\;500℃\;}}{}$3V2O4+N2+3H2O。
解析
步骤 1:焙烧反应
V_2O_3与氧气、氯化钠混合中煅烧,转化为NaVO_3的过程中V元素被氧气氧化,根据电子守恒和元素守恒可得化学方程式为V_2O_3+O_2+2NaCl+H_2O$\frac{\underline{\;高温\;}}{\;}$2NaVO_3+2HCl。
步骤 2:滤液I成分
根据复分解反应交换成分可知,硅酸钠和氢氧化钙反应生成Ca(SiO_3)_2沉淀和NaOH,故滤液为NaOH,先“转沉”后“转化”的目的是富集钒元素。
步骤 3:滤渣II循环使用
滤渣Ⅱ是煅烧生成CaO,与水反应生成氢氧化钙,可到转沉中循环使用。
步骤 4:沉钒过程
沉钒过程发生复分解反应,离子方程式为NH_4^{+}+VO_3^{-}=NH_4VO_3↓,利用同离子效应,促进NH_4VO_3尽可能析出完全,铵根离子先酸性,调节pH,将$VO_4^{3-}$转化为$VO_3^-$,已知:K_sp(NH_4VO_3)=1.6×10^{-3},若滤液中c(VO_3^{-})=0.2mol•L^{-1},为使钒元素的沉降率达到96%,则此时c(VO_3^{-})=0.008mol/L,至少应调节c(NH_4^{+})=$\frac{{K}_{\;sp}}{c(VO{}_{3}{}^{−})}$=$\frac{1.6×10{}^{−3}}{0.008}$mol/L=0.2mol/L。
步骤 5:氧化还原反应
反应中氧化剂与还原剂物质的量之比为3:2,设氧化产物中N元素化合价为x,根据转移电子守恒得3×2×(5-4)=2×[x-(-3)],则x=0,所以氧化产物为氮气,根据元素守恒知,还生成水,所以反应方程式为3V_2O_5+2NH_3$\frac{\underline{\;500℃\;}}{}$3V_2O_4+N_2+3H_2O。
V_2O_3与氧气、氯化钠混合中煅烧,转化为NaVO_3的过程中V元素被氧气氧化,根据电子守恒和元素守恒可得化学方程式为V_2O_3+O_2+2NaCl+H_2O$\frac{\underline{\;高温\;}}{\;}$2NaVO_3+2HCl。
步骤 2:滤液I成分
根据复分解反应交换成分可知,硅酸钠和氢氧化钙反应生成Ca(SiO_3)_2沉淀和NaOH,故滤液为NaOH,先“转沉”后“转化”的目的是富集钒元素。
步骤 3:滤渣II循环使用
滤渣Ⅱ是煅烧生成CaO,与水反应生成氢氧化钙,可到转沉中循环使用。
步骤 4:沉钒过程
沉钒过程发生复分解反应,离子方程式为NH_4^{+}+VO_3^{-}=NH_4VO_3↓,利用同离子效应,促进NH_4VO_3尽可能析出完全,铵根离子先酸性,调节pH,将$VO_4^{3-}$转化为$VO_3^-$,已知:K_sp(NH_4VO_3)=1.6×10^{-3},若滤液中c(VO_3^{-})=0.2mol•L^{-1},为使钒元素的沉降率达到96%,则此时c(VO_3^{-})=0.008mol/L,至少应调节c(NH_4^{+})=$\frac{{K}_{\;sp}}{c(VO{}_{3}{}^{−})}$=$\frac{1.6×10{}^{−3}}{0.008}$mol/L=0.2mol/L。
步骤 5:氧化还原反应
反应中氧化剂与还原剂物质的量之比为3:2,设氧化产物中N元素化合价为x,根据转移电子守恒得3×2×(5-4)=2×[x-(-3)],则x=0,所以氧化产物为氮气,根据元素守恒知,还生成水,所以反应方程式为3V_2O_5+2NH_3$\frac{\underline{\;500℃\;}}{}$3V_2O_4+N_2+3H_2O。