题目
17.30.0mL0.150mol/L 的HCl溶液和 20.0mL0.150mol/L 的Ba(OH)2溶液相混合,所得-|||-溶液是酸性、中性、还是碱性?计算过量反应物的浓度。

题目解答
答案
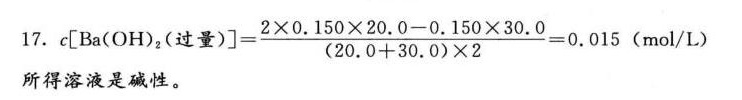
解析
步骤 1:确定反应物的摩尔数
首先,计算HCl和Ba(OH)2的摩尔数。HCl的摩尔数为0.150 mol/L * 0.030 L = 0.0045 mol,Ba(OH)2的摩尔数为0.150 mol/L * 0.020 L = 0.003 mol。
步骤 2:确定反应物的化学计量比
HCl和Ba(OH)2反应的化学方程式为:2HCl + Ba(OH)2 -> BaCl2 + 2H2O。根据化学方程式,2 mol HCl与1 mol Ba(OH)2反应。因此,0.0045 mol HCl需要0.00225 mol Ba(OH)2,而Ba(OH)2的摩尔数为0.003 mol,所以Ba(OH)2过量。
步骤 3:计算过量反应物的浓度
过量的Ba(OH)2的摩尔数为0.003 mol - 0.00225 mol = 0.00075 mol。混合后的总体积为30.0 mL + 20.0 mL = 50.0 mL = 0.050 L。因此,过量的Ba(OH)2的浓度为0.00075 mol / 0.050 L = 0.015 mol/L。
首先,计算HCl和Ba(OH)2的摩尔数。HCl的摩尔数为0.150 mol/L * 0.030 L = 0.0045 mol,Ba(OH)2的摩尔数为0.150 mol/L * 0.020 L = 0.003 mol。
步骤 2:确定反应物的化学计量比
HCl和Ba(OH)2反应的化学方程式为:2HCl + Ba(OH)2 -> BaCl2 + 2H2O。根据化学方程式,2 mol HCl与1 mol Ba(OH)2反应。因此,0.0045 mol HCl需要0.00225 mol Ba(OH)2,而Ba(OH)2的摩尔数为0.003 mol,所以Ba(OH)2过量。
步骤 3:计算过量反应物的浓度
过量的Ba(OH)2的摩尔数为0.003 mol - 0.00225 mol = 0.00075 mol。混合后的总体积为30.0 mL + 20.0 mL = 50.0 mL = 0.050 L。因此,过量的Ba(OH)2的浓度为0.00075 mol / 0.050 L = 0.015 mol/L。