题目
自1909年德国化学家哈伯经过反复实验研究出合成氨的条件,1913年实现工业化生产,合成氨一直是人工固氮的最主要方式。氨气是一种重要的工业原料,可用于制取硝酸和肥料。为增加氨的产量,化学家们一直在研究调控合成氨的反应条件和措施。(1)合成氨原料气通常由石油裂解气获得,某含34个氢原子链状烷烃是制氢原料之一,则该烃分子式为 ____ 。(2)已知:NH3中N—H键能为391kJ•mol-1,N2中键能为945.6kJ•mol-1,H2中H—H键能为436kJ•mol-1,则合成1.0mol NH3 ____ (填“吸收”或“放出”) ____ kJ热量。(3)某温度下,向2.0L的恒容密闭容器中充入2.0mol N2和6.0mol H2,发生合成氨反应,实验数据如下表所示: t/s 0 50 150 250 350 n(NH3)/mol 0 0.24 0.36 0.40 0.40 ①0~50s内的平均反应速率v(N2)= ____ ,氨气的平衡含量为 ____ %(保留两位有效数字)。②工业上恒温恒容时随反应的进行,气体的物质的量减少,压强减小,当容器压强不变时说明已达平衡状态,此时容器中下列数据也不再变化的是 ____ (填标号)。a.氨气的含量b.气体的密度c.N2和H2的物质的量之比(4)现在化学家们研究电化学方法N2和H2合成氨(如图),则气体a是 ____ (填化学式),电极2发生的电极反应为 ____ 。e^--|||-电极1 电极2-|||-a → ←b-|||-KOH溶液
自1909年德国化学家哈伯经过反复实验研究出合成氨的条件,1913年实现工业化生产,合成氨一直是人工固氮的最主要方式。氨气是一种重要的工业原料,可用于制取硝酸和肥料。为增加氨的产量,化学家们一直在研究调控合成氨的反应条件和措施。
(1)合成氨原料气通常由石油裂解气获得,某含34个氢原子链状烷烃是制氢原料之一,则该烃分子式为 ____ 。
(2)已知:NH3中N—H键能为391kJ•mol-1,N2中键能为945.6kJ•mol-1,H2中H—H键能为436kJ•mol-1,则合成1.0mol NH3 ____ (填“吸收”或“放出”) ____ kJ热量。
(3)某温度下,向2.0L的恒容密闭容器中充入2.0mol N2和6.0mol H2,发生合成氨反应,实验数据如下表所示:
①0~50s内的平均反应速率v(N2)= ____ ,氨气的平衡含量为 ____ %(保留两位有效数字)。
②工业上恒温恒容时随反应的进行,气体的物质的量减少,压强减小,当容器压强不变时说明已达平衡状态,此时容器中下列数据也不再变化的是 ____ (填标号)。
a.氨气的含量
b.气体的密度
c.N2和H2的物质的量之比
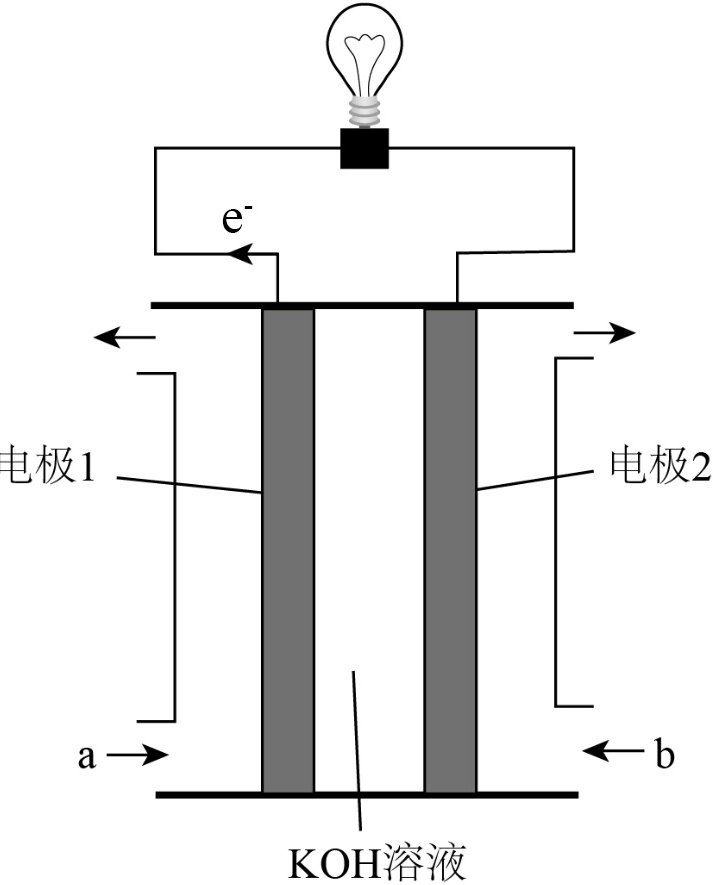
(4)现在化学家们研究电化学方法N2和H2合成氨(如图),则气体a是 ____ (填化学式),电极2发生的电极反应为 ____ 。
(1)合成氨原料气通常由石油裂解气获得,某含34个氢原子链状烷烃是制氢原料之一,则该烃分子式为 ____ 。
(2)已知:NH3中N—H键能为391kJ•mol-1,N2中键能为945.6kJ•mol-1,H2中H—H键能为436kJ•mol-1,则合成1.0mol NH3 ____ (填“吸收”或“放出”) ____ kJ热量。
(3)某温度下,向2.0L的恒容密闭容器中充入2.0mol N2和6.0mol H2,发生合成氨反应,实验数据如下表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
②工业上恒温恒容时随反应的进行,气体的物质的量减少,压强减小,当容器压强不变时说明已达平衡状态,此时容器中下列数据也不再变化的是 ____ (填标号)。
a.氨气的含量
b.气体的密度
c.N2和H2的物质的量之比
(4)现在化学家们研究电化学方法N2和H2合成氨(如图),则气体a是 ____ (填化学式),电极2发生的电极反应为 ____ 。

题目解答
答案
(1)烷烃的通式为CnH2n+2,含34个氢原子链状烷烃n=16,故该烃分子式为:C16H34;
(2)合成氨反应的方程式为:${N}_{2}+3{H}_{2}⇌_{催化剂}^{高温高压}2N{H}_{3}$,ΔΗ=[945.6+3×436-2×3×391]kJ/mol=-92.4kJ/mol,即合成2.0mol NH3放出92.4kJ的热量,故合成1.0mol NH3放出46.2kJ热量;
(3)①0~50s内的平均反应速率v(N2)=$\frac{1}{2}v(N{H}_{3})=\frac{1}{2}×\frac{0.24mol}{2.0L×50s}=0.0012\;mol•{L}^{-1}•{s}^{-1}$,根据表格中数据,平衡时NH3的物质的量为0.40mol,故可列出三段式:$\begin{array}{c}{}\\ 起始(mol)\\ 转化(mol)\\ 平衡(mol)\end{array}\begin{array}{c}{N}_{2}(g)\\ 2.0\\ 0.20\\ 1.80\end{array}$,NH3的平衡含量为:$\frac{0.40}{1.80+5.40+0.40}×100%=5.3%$;
②a.达到平衡时氨气的含量不变,a正确;
b.恒容条件下气体的总质量不变,气体的密度一直不变,与是否达到平衡无关,b错误;
c.N2和H2的投料比为系数比,物质的量之比始终等于1:3,与是否达到平衡无关,c错误;
故选a;
(4)合成氨反应中N元素化合价降低,H元素化合价升高,故H2在负极反应,电极1为负极,N2在正极反应,电极2为正极。根据以上分析,气体a是H2,电极2发生的电极反应为:${N}_{2}+6{e}^{-}+6{H}_{2}O=2N{H}_{3}+6O{H}^{-}$。
(2)合成氨反应的方程式为:${N}_{2}+3{H}_{2}⇌_{催化剂}^{高温高压}2N{H}_{3}$,ΔΗ=[945.6+3×436-2×3×391]kJ/mol=-92.4kJ/mol,即合成2.0mol NH3放出92.4kJ的热量,故合成1.0mol NH3放出46.2kJ热量;
(3)①0~50s内的平均反应速率v(N2)=$\frac{1}{2}v(N{H}_{3})=\frac{1}{2}×\frac{0.24mol}{2.0L×50s}=0.0012\;mol•{L}^{-1}•{s}^{-1}$,根据表格中数据,平衡时NH3的物质的量为0.40mol,故可列出三段式:$\begin{array}{c}{}\\ 起始(mol)\\ 转化(mol)\\ 平衡(mol)\end{array}\begin{array}{c}{N}_{2}(g)\\ 2.0\\ 0.20\\ 1.80\end{array}$,NH3的平衡含量为:$\frac{0.40}{1.80+5.40+0.40}×100%=5.3%$;
②a.达到平衡时氨气的含量不变,a正确;
b.恒容条件下气体的总质量不变,气体的密度一直不变,与是否达到平衡无关,b错误;
c.N2和H2的投料比为系数比,物质的量之比始终等于1:3,与是否达到平衡无关,c错误;
故选a;
(4)合成氨反应中N元素化合价降低,H元素化合价升高,故H2在负极反应,电极1为负极,N2在正极反应,电极2为正极。根据以上分析,气体a是H2,电极2发生的电极反应为:${N}_{2}+6{e}^{-}+6{H}_{2}O=2N{H}_{3}+6O{H}^{-}$。