题目
13.常温下,一元酸HA的 _(a)(HA)=1.0times (10)^-3 在某体系中, ^+ 与 ^- 离子不能穿过-|||-隔膜,未电离的HA可自由穿过该膜(如图所示),-|||-溶液I 膜 溶液II-|||-=7.0 =1.0-|||-H^++A^-=HA HA=H^++A^--|||-设溶液中 _(a)(HA)=c(HA)+c((A)^-), 当达到平衡时,下列叙述正确的是 ()-|||-A.溶液I中 ((H)^+)=c((OH)^-)+c((A)^-)-|||-B.溶液Ⅱ中的HA的电离度 (dfrac (c({A)^-)}({c)_(A)(HA)}) 为dfrac (1)(101)-|||-C.溶液I和Ⅱ中的c(H A)不相等-|||-D.溶液I和Ⅱ中的c.(HA)之比为 -4
题目解答
答案
【答案】
B
【解析】
A.常温下溶液I的pH=7.0,则溶液I中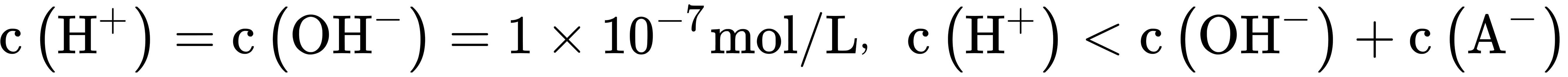 ,A错误;
,A错误;
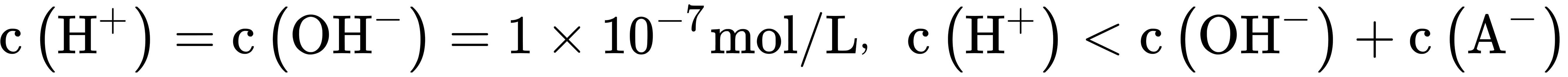 ,A错误;
,A错误;B.常温下溶液II的pH=1.0,溶液中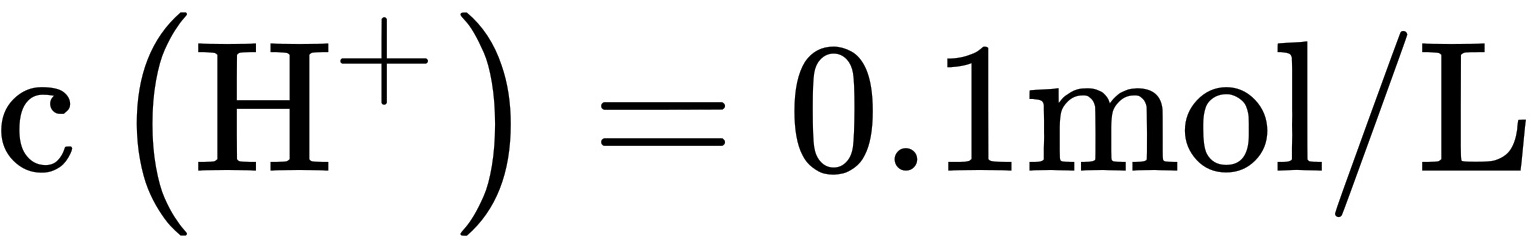 ,
,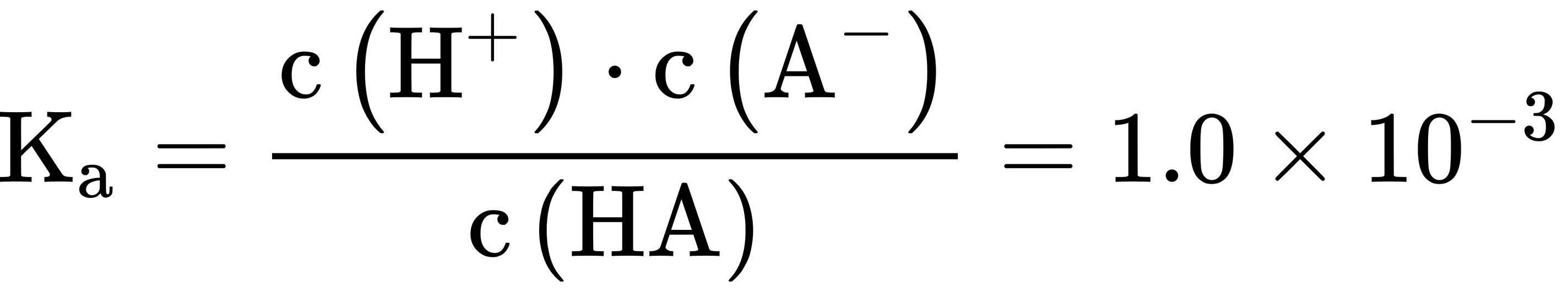 ,
,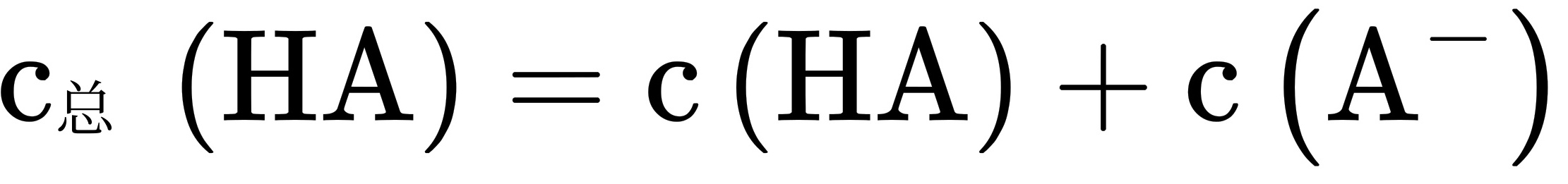 ,则
,则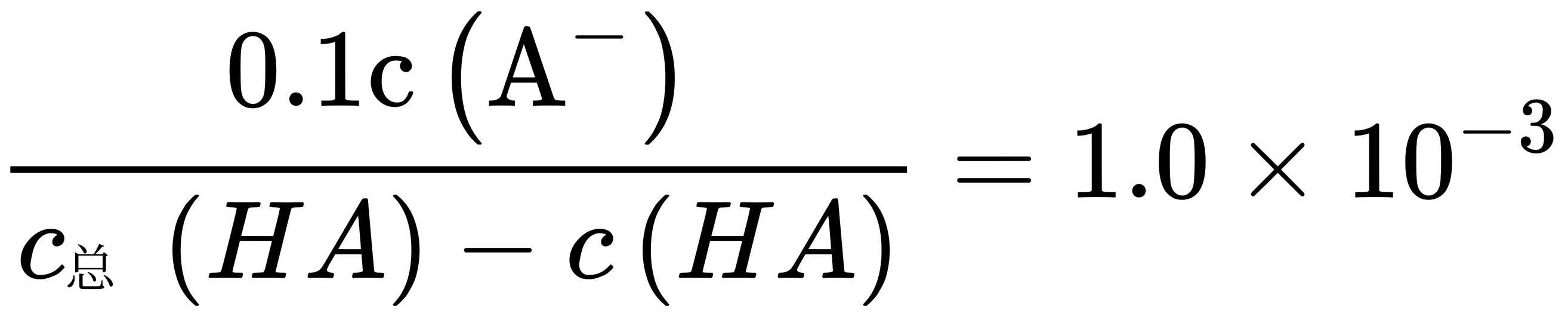 ,解得
,解得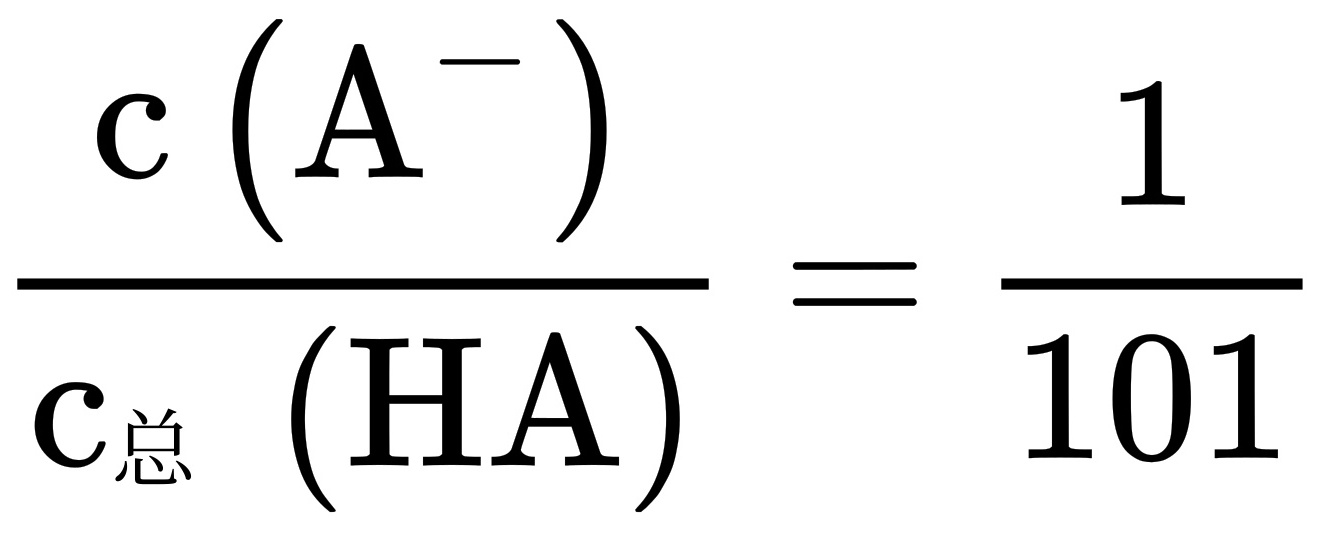 ,B正确;
,B正确;
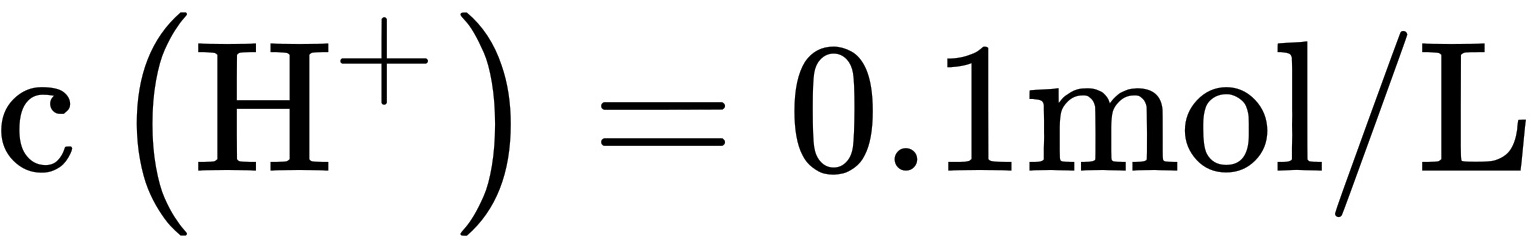 ,
,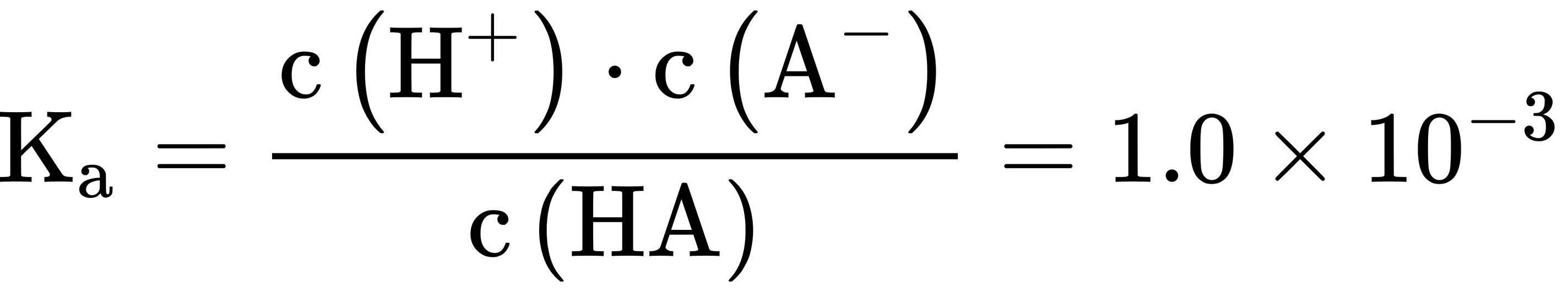 ,
,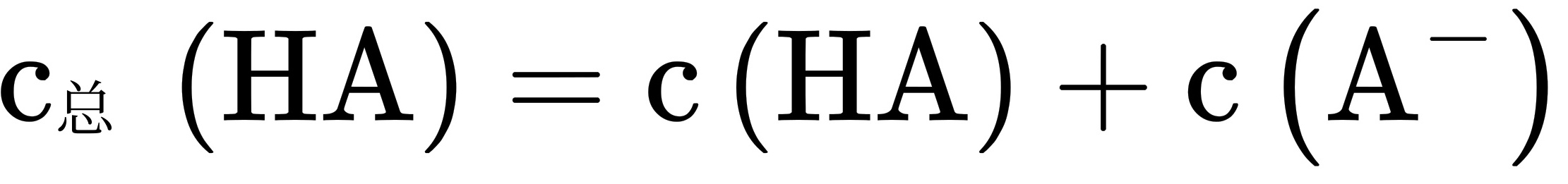 ,则
,则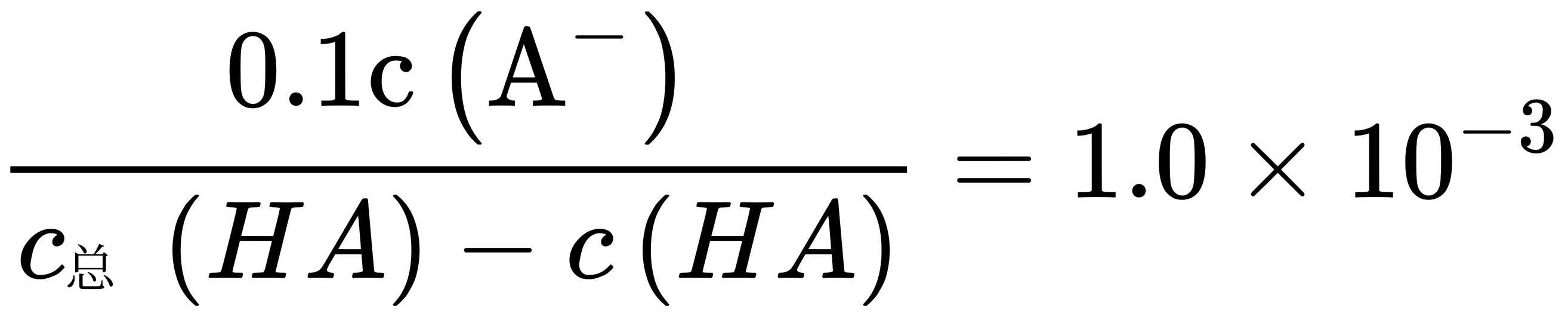 ,解得
,解得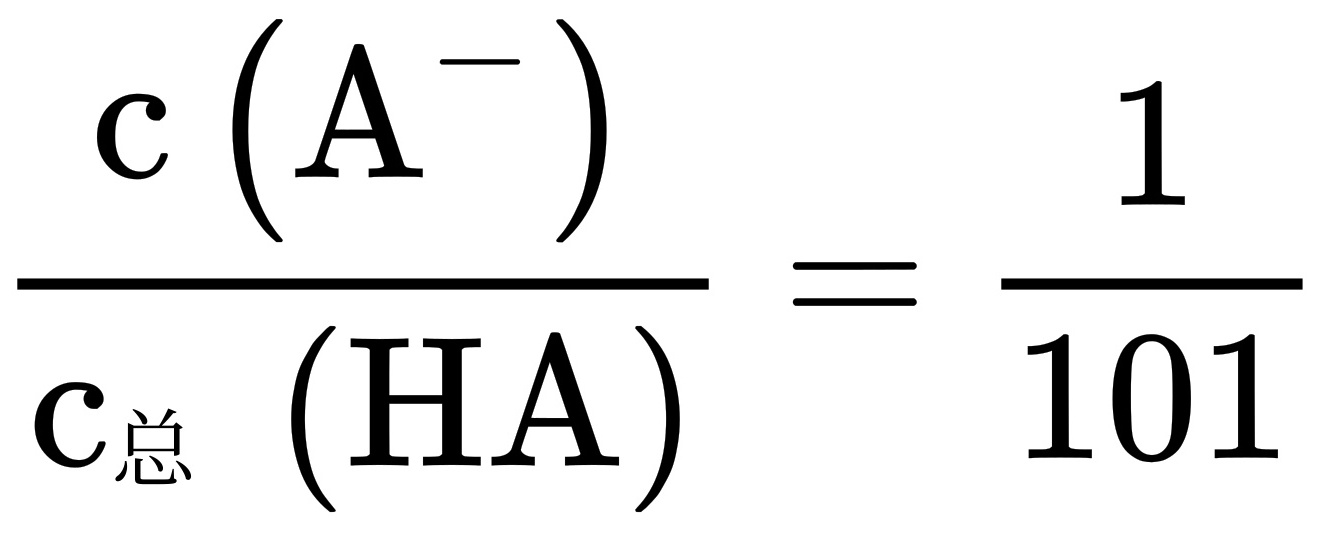 ,B正确;
,B正确;C.根据题意,未电离的HA可自由穿过隔膜,故溶液I和II中的c(HA)相等,C错误;
D.常温下溶液I的pH=7.0,溶液I中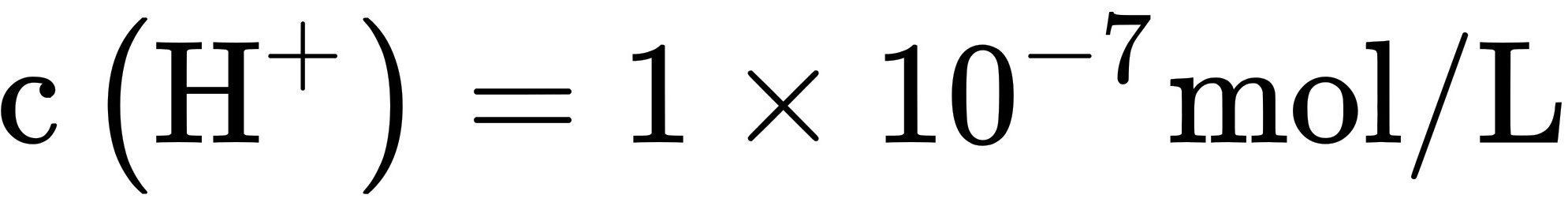 ,
,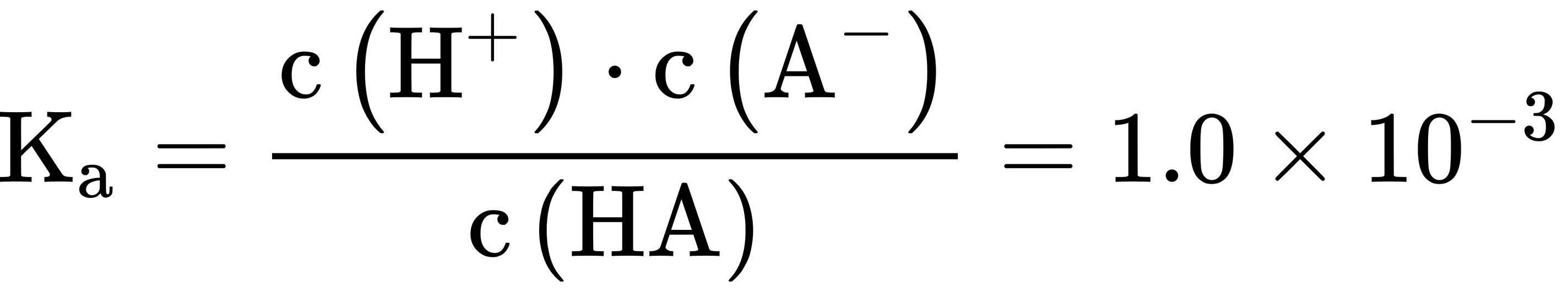 ,
,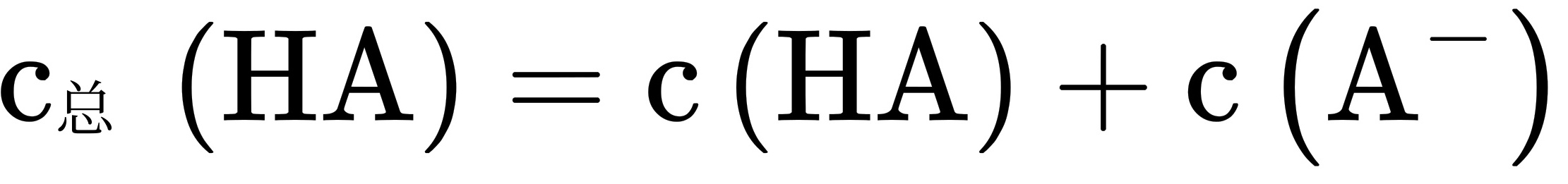 ,
,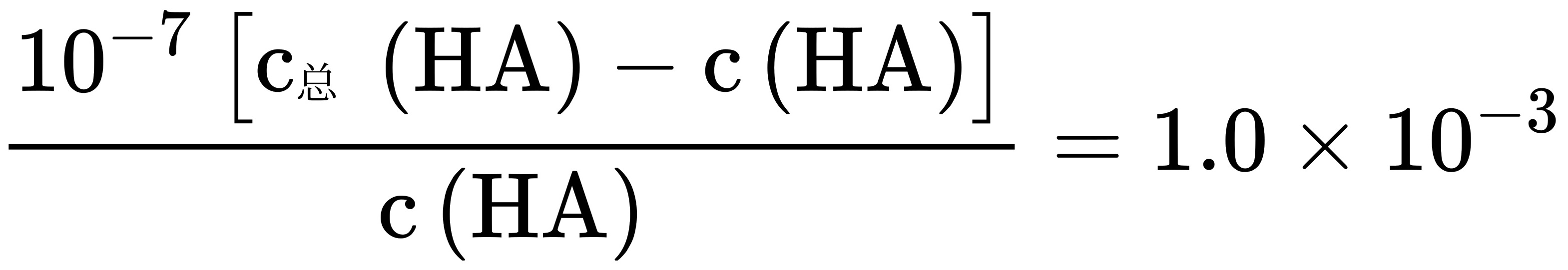 ,溶液I中
,溶液I中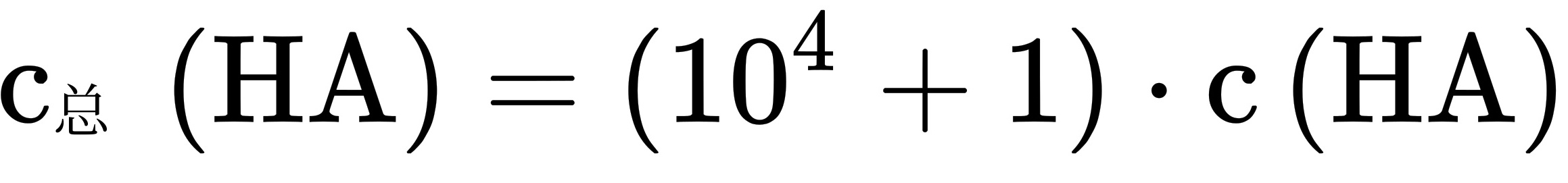 ,溶液II的pH=1.0,溶液II中
,溶液II的pH=1.0,溶液II中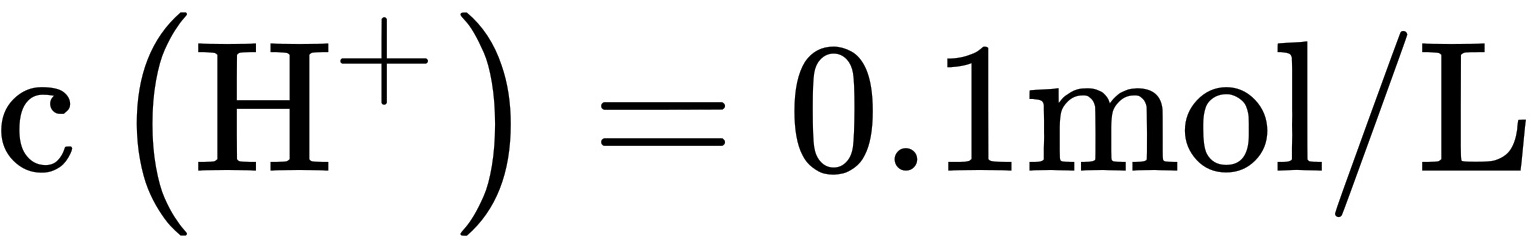 ,
,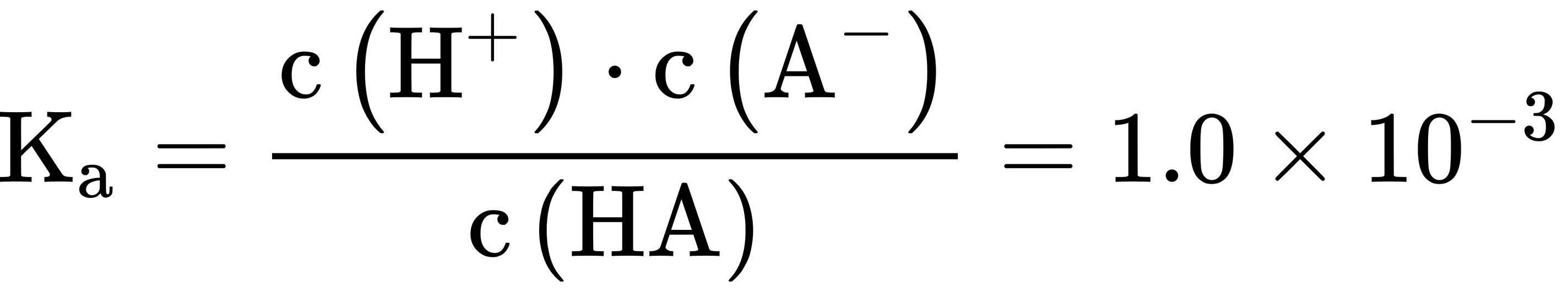 ,
,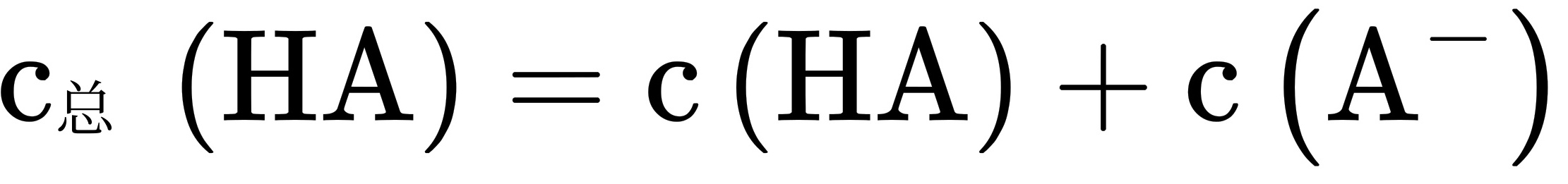 ,
,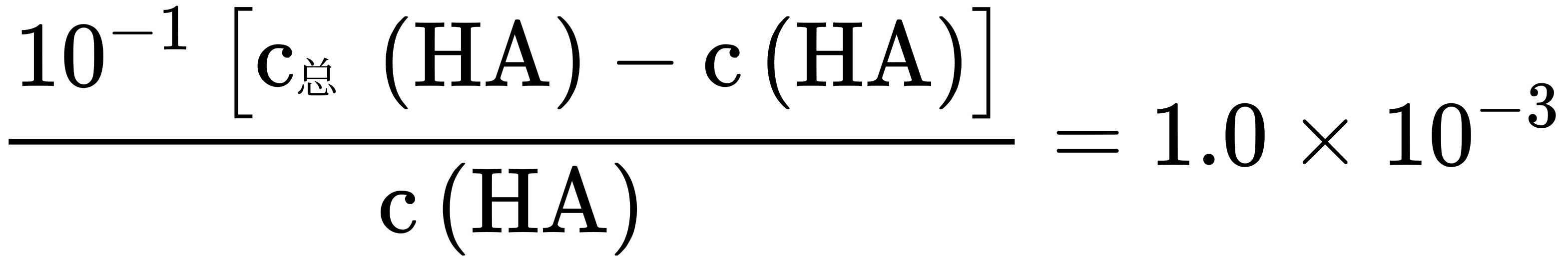 ,溶液II中
,溶液II中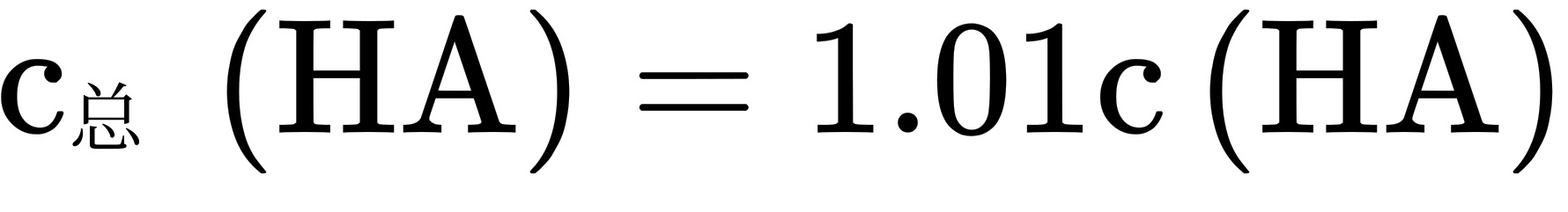 ,未电离的HA可自由穿过隔膜,故溶液I和II中的
,未电离的HA可自由穿过隔膜,故溶液I和II中的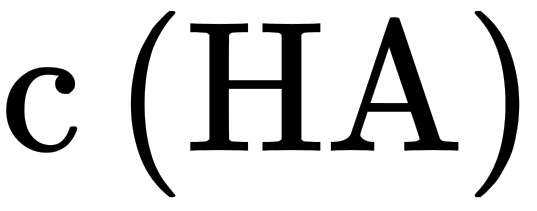 相等,溶液I和II中
相等,溶液I和II中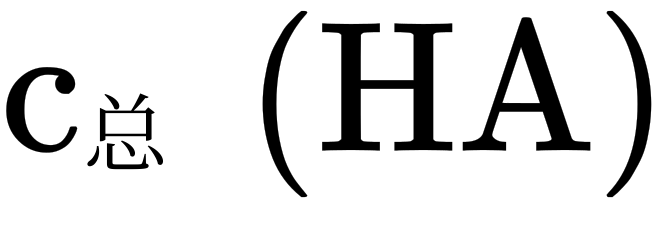 之比为
之比为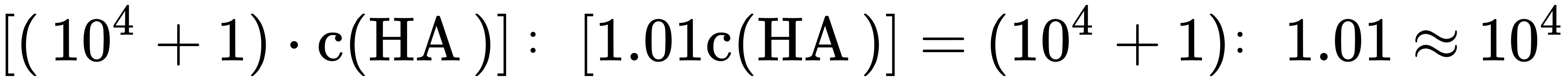 ,D错误;
,D错误;
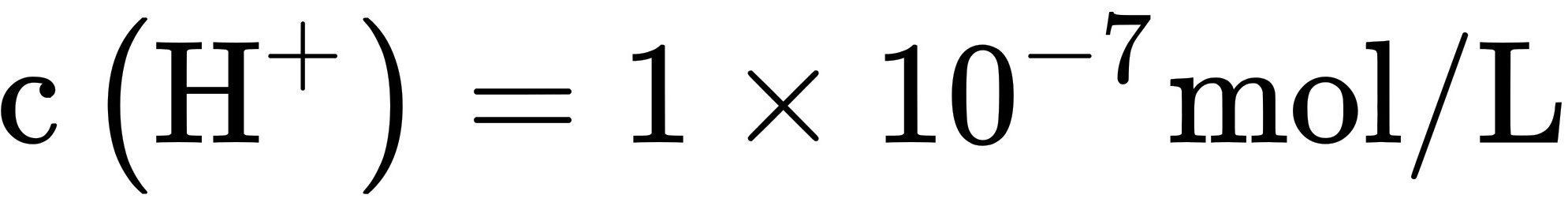 ,
,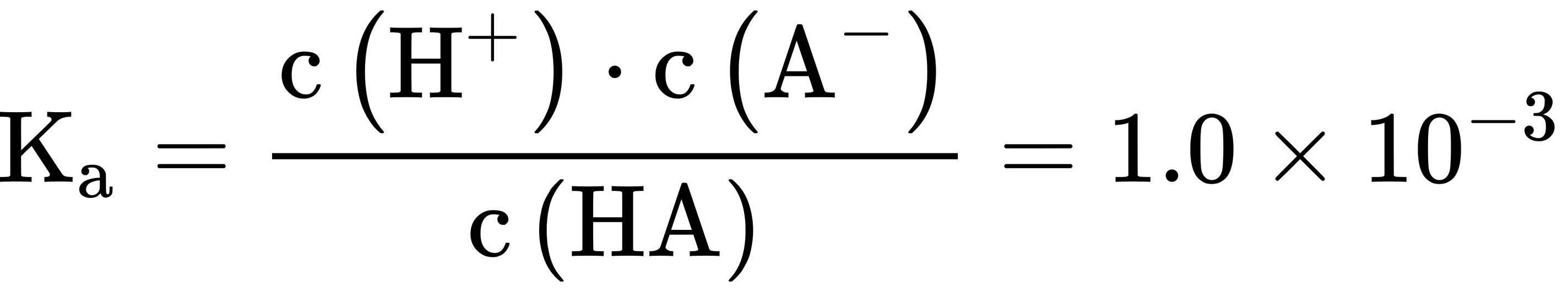 ,
,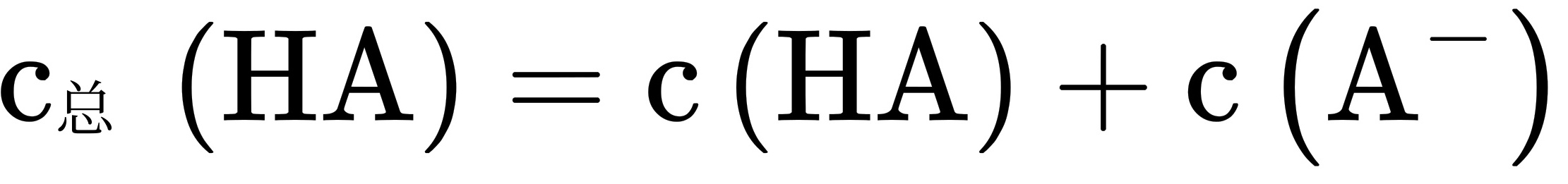 ,
,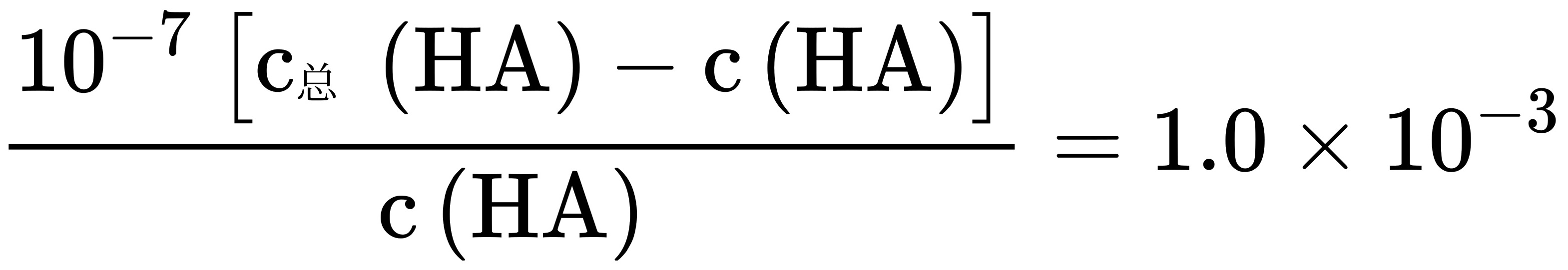 ,溶液I中
,溶液I中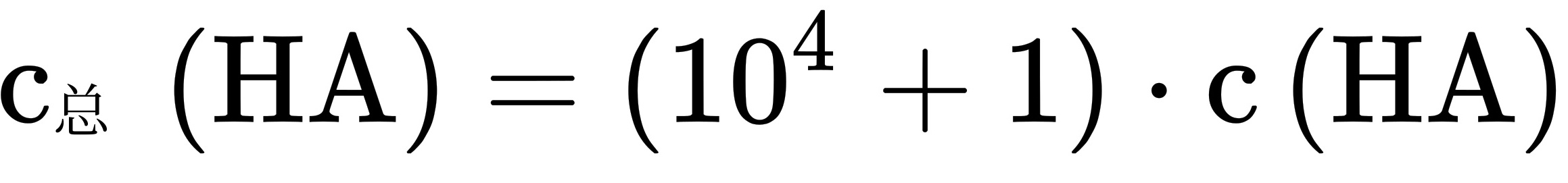 ,溶液II的pH=1.0,溶液II中
,溶液II的pH=1.0,溶液II中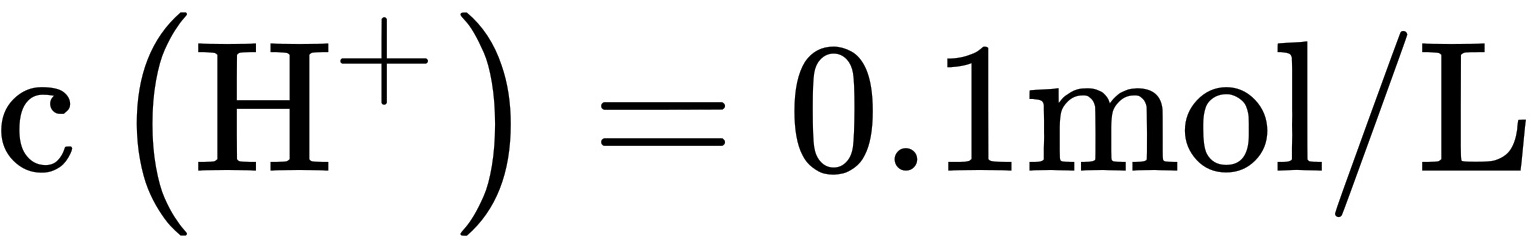 ,
,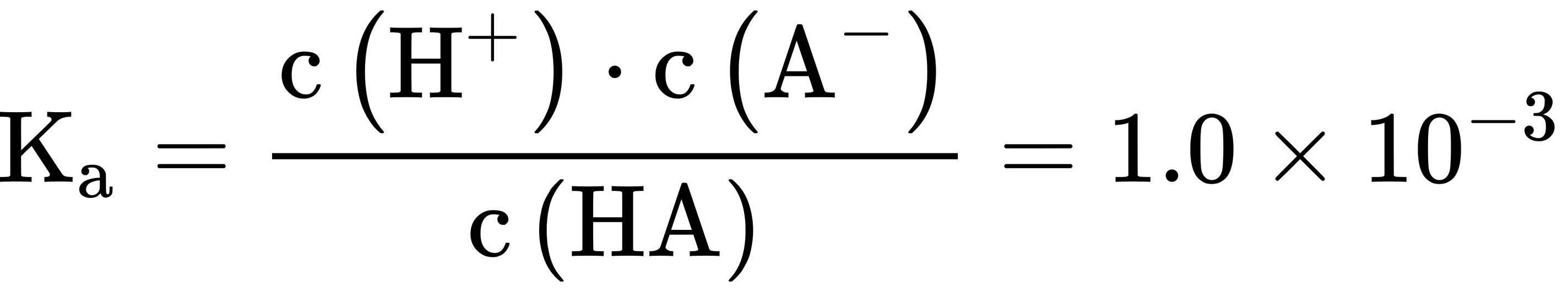 ,
,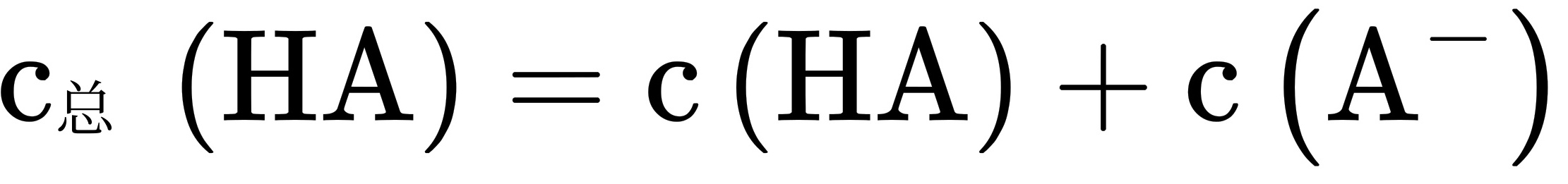 ,
,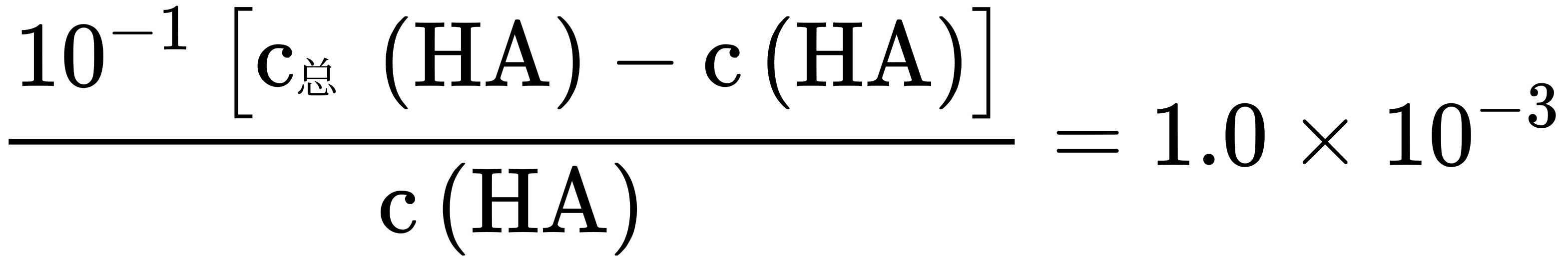 ,溶液II中
,溶液II中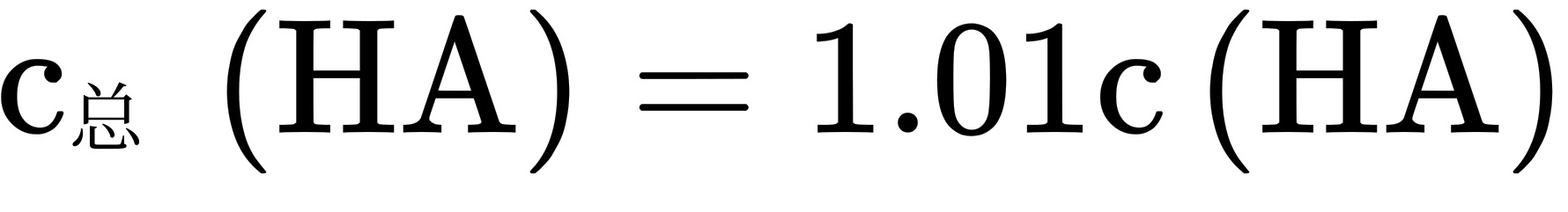 ,未电离的HA可自由穿过隔膜,故溶液I和II中的
,未电离的HA可自由穿过隔膜,故溶液I和II中的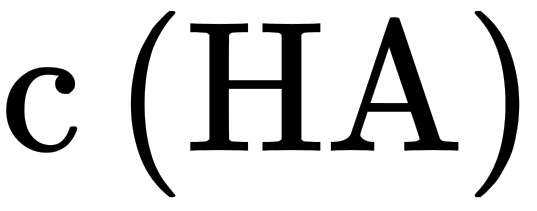 相等,溶液I和II中
相等,溶液I和II中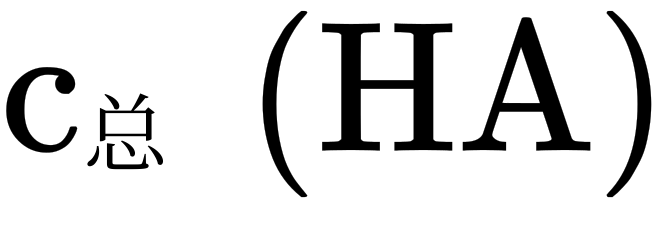 之比为
之比为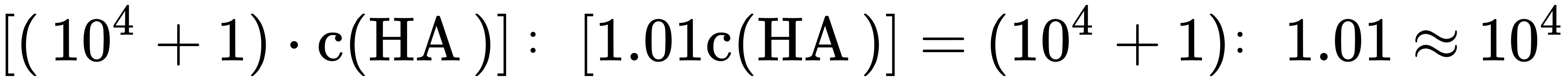 ,D错误;
,D错误;答案选B。
解析
步骤 1:分析溶液I的pH值
常温下溶液I的pH=7.0,说明溶液I中$c({H}^{+})=c({OH}^{-})=1\times {10}^{-7}mol/L$。由于${H}^{+}$与${A}^{-}$离子不能穿过隔膜,所以溶液I中$c({H}^{+})\lt c({OH}^{-})+c({A}^{-})$,因此A选项错误。
步骤 2:分析溶液II的pH值
常温下溶液II的pH=1.0,说明溶液II中$c({H}^{+})=0.1mol/L$。根据${K}_{a}(HA)=1.0\times {10}^{-3}$,可以计算出溶液II中HA的电离度为$\dfrac {c({A}^{-})}{{c}_{A}(HA)}=\dfrac {1}{101}$,因此B选项正确。
步骤 3:分析溶液I和II中的c(HA)
由于未电离的HA可自由穿过隔膜,所以溶液I和II中的c(HA)相等,因此C选项错误。根据步骤2的计算,溶液I和II中的c(HA)之比为$10^{-4}$,因此D选项错误。
常温下溶液I的pH=7.0,说明溶液I中$c({H}^{+})=c({OH}^{-})=1\times {10}^{-7}mol/L$。由于${H}^{+}$与${A}^{-}$离子不能穿过隔膜,所以溶液I中$c({H}^{+})\lt c({OH}^{-})+c({A}^{-})$,因此A选项错误。
步骤 2:分析溶液II的pH值
常温下溶液II的pH=1.0,说明溶液II中$c({H}^{+})=0.1mol/L$。根据${K}_{a}(HA)=1.0\times {10}^{-3}$,可以计算出溶液II中HA的电离度为$\dfrac {c({A}^{-})}{{c}_{A}(HA)}=\dfrac {1}{101}$,因此B选项正确。
步骤 3:分析溶液I和II中的c(HA)
由于未电离的HA可自由穿过隔膜,所以溶液I和II中的c(HA)相等,因此C选项错误。根据步骤2的计算,溶液I和II中的c(HA)之比为$10^{-4}$,因此D选项错误。