题目
[题目]-|||-3.26g样品燃烧后,得到4.74gCO2和1.92gH 2-|||-O,实验测得其相对分子质量为60,求该样品的实-|||-验式和分子式。

题目解答
答案
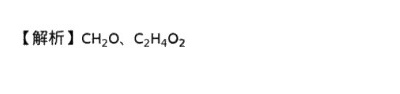
解析
步骤 1:计算样品中碳和氢的质量
根据化学反应,燃烧产物CO2和H2O中的碳和氢分别来自样品。因此,可以通过计算CO2和H2O中碳和氢的质量来确定样品中碳和氢的质量。
- CO2中碳的质量:4.74g * (12g/mol / 44g/mol) = 1.26g
- H2O中氢的质量:1.92g * (2g/mol / 18g/mol) = 0.21g
步骤 2:计算样品中碳和氢的摩尔数
- 碳的摩尔数:1.26g / 12g/mol = 0.105mol
- 氢的摩尔数:0.21g / 1g/mol = 0.21mol
步骤 3:计算样品中氧的质量
样品的质量为3.26g,碳和氢的质量之和为1.26g + 0.21g = 1.47g,因此氧的质量为3.26g - 1.47g = 1.79g。
步骤 4:计算样品中氧的摩尔数
氧的摩尔数:1.79g / 16g/mol = 0.112mol
步骤 5:计算样品中碳、氢、氧的摩尔比
- 碳的摩尔比:0.105mol / 0.105mol = 1
- 氢的摩尔比:0.21mol / 0.105mol = 2
- 氧的摩尔比:0.112mol / 0.105mol ≈ 1
步骤 6:确定样品的实验式和分子式
根据步骤5的摩尔比,样品的实验式为CH2O。由于实验测得的相对分子质量为60,而CH2O的相对分子质量为30,因此样品的分子式为C2H4O2。
根据化学反应,燃烧产物CO2和H2O中的碳和氢分别来自样品。因此,可以通过计算CO2和H2O中碳和氢的质量来确定样品中碳和氢的质量。
- CO2中碳的质量:4.74g * (12g/mol / 44g/mol) = 1.26g
- H2O中氢的质量:1.92g * (2g/mol / 18g/mol) = 0.21g
步骤 2:计算样品中碳和氢的摩尔数
- 碳的摩尔数:1.26g / 12g/mol = 0.105mol
- 氢的摩尔数:0.21g / 1g/mol = 0.21mol
步骤 3:计算样品中氧的质量
样品的质量为3.26g,碳和氢的质量之和为1.26g + 0.21g = 1.47g,因此氧的质量为3.26g - 1.47g = 1.79g。
步骤 4:计算样品中氧的摩尔数
氧的摩尔数:1.79g / 16g/mol = 0.112mol
步骤 5:计算样品中碳、氢、氧的摩尔比
- 碳的摩尔比:0.105mol / 0.105mol = 1
- 氢的摩尔比:0.21mol / 0.105mol = 2
- 氧的摩尔比:0.112mol / 0.105mol ≈ 1
步骤 6:确定样品的实验式和分子式
根据步骤5的摩尔比,样品的实验式为CH2O。由于实验测得的相对分子质量为60,而CH2O的相对分子质量为30,因此样品的分子式为C2H4O2。