题目
(a)在MgO晶体中,肖特基缺陷的生成能为6 ev,计算在25℃和1600℃时热缺陷的浓度。(b)如果MgO晶体中,含有百万分之一mol的Al2O3杂质,则在1600℃时,MgO晶体中是热缺陷占优势还是杂质缺陷占优势?说明原因。
(a)在MgO晶体中,肖特基缺陷的生成能为6 ev,计算在25℃和1600℃时热缺陷的浓度。
(b)如果MgO晶体中,含有百万分之一mol的Al2O3杂质,则在1600℃时,MgO晶体中是热缺陷占优势还是杂质缺陷占优势?说明原因。
题目解答
答案
解:(a)根据热缺陷浓度公式: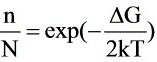
由题意 △G = 6 ev = 6×1.602×10-19
= 9.612×10-19 J
K = 1.38×10-23 J/K
T1 = 25+273= 298 K
T2 = 1600+273=1873 K
298K: 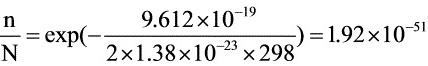
1873K: 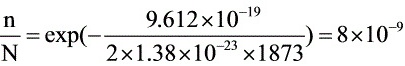
(b)在MgO中加入百万分之一的Al2O3杂质,缺陷反应方程为:
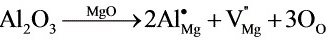
此时产生的缺陷为[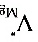 ]杂质。
]杂质。
而由上式可知:[Al2O3]=[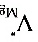 ]杂质
]杂质
∴当加入10-6 Al2O3时,杂质缺陷的浓度为
[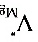 ]杂质=[Al2O3] = 10-6
]杂质=[Al2O3] = 10-6
由(a)计算结果可知:在1873 K,[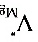 ]热= 8×10-9
]热= 8×10-9
显然: [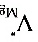 ]杂质>[
]杂质>[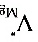 ]热,所以在1873 K时杂质缺陷占优势。
]热,所以在1873 K时杂质缺陷占优势。
解析
步骤 1:计算热缺陷浓度
根据热缺陷浓度公式:$\dfrac {n}{N}=eXP(-\dfrac {\Delta G}{2kT})$
其中,△G = 6 eV = 6×1.602×10-19 J = 9.612×10-19 J
K = 1.38×10-23 J/K
T1 = 25+273= 298 K
T2 = 1600+273=1873 K
步骤 2:计算298K时的热缺陷浓度
$\dfrac {n}{N}=e\times p(-\dfrac {9.612\times {10}^{-19}}{2\times 1.38\times {10}^{-23}\times 298})=1.92\times {10}^{-51}$
步骤 3:计算1873K时的热缺陷浓度
$\dfrac {n}{N}=e\times p(-\dfrac {9.612\times {10}^{-19}}{2\times 1.38\times {10}^{-23}\times 1873})=8\times {10}^{-9}$
步骤 4:计算杂质缺陷浓度
在MgO中加入百万分之一的Al2O3杂质,缺陷反应方程为:
${Al}_{2}{O}_{3}\xrightarrow {MgO}2{Al}_{Mg}+{{V}_{MB}}^{2}+3{O}_{0}$
此时产生的缺陷为[Mg]杂质。
而由上式可知:[Al2O3]=[Mg]杂质
∴当加入10-6 Al2O3时,杂质缺陷的浓度为
[Mg]杂质=[Al2O3] = 10-6
步骤 5:比较热缺陷和杂质缺陷浓度
由步骤3计算结果可知:在1873 K,[Mg]热= 8×10-9
显然:[Mg]杂质>[Mg]热,所以在1873 K时杂质缺陷占优势。
根据热缺陷浓度公式:$\dfrac {n}{N}=eXP(-\dfrac {\Delta G}{2kT})$
其中,△G = 6 eV = 6×1.602×10-19 J = 9.612×10-19 J
K = 1.38×10-23 J/K
T1 = 25+273= 298 K
T2 = 1600+273=1873 K
步骤 2:计算298K时的热缺陷浓度
$\dfrac {n}{N}=e\times p(-\dfrac {9.612\times {10}^{-19}}{2\times 1.38\times {10}^{-23}\times 298})=1.92\times {10}^{-51}$
步骤 3:计算1873K时的热缺陷浓度
$\dfrac {n}{N}=e\times p(-\dfrac {9.612\times {10}^{-19}}{2\times 1.38\times {10}^{-23}\times 1873})=8\times {10}^{-9}$
步骤 4:计算杂质缺陷浓度
在MgO中加入百万分之一的Al2O3杂质,缺陷反应方程为:
${Al}_{2}{O}_{3}\xrightarrow {MgO}2{Al}_{Mg}+{{V}_{MB}}^{2}+3{O}_{0}$
此时产生的缺陷为[Mg]杂质。
而由上式可知:[Al2O3]=[Mg]杂质
∴当加入10-6 Al2O3时,杂质缺陷的浓度为
[Mg]杂质=[Al2O3] = 10-6
步骤 5:比较热缺陷和杂质缺陷浓度
由步骤3计算结果可知:在1873 K,[Mg]热= 8×10-9
显然:[Mg]杂质>[Mg]热,所以在1873 K时杂质缺陷占优势。