题目
钢铁的电化学腐蚀根据钢铁表面水溶液薄膜的酸碱性不同,钢铁的电化学腐蚀分为析氢腐蚀和吸氧腐蚀。铜板上铁铆钉处的电化学腐蚀如下图所示:^2+OOH H2-|||-A-|||-水膜 - H2 bigcirc -|||-Cu Fe Cu-|||-表示 Fe^2+^2+OOH H2-|||-A-|||-水膜 - H2 bigcirc -|||-Cu Fe Cu-|||-表示 Fe^2+铁钉的析氢腐蚀示意图铁钉的吸氧腐蚀示意图(1)析氢腐蚀:当铁钉表面的电解质溶液________较强时,腐蚀过程中有H2放出。负极:Fe-2e-===Fe2+;正极:2H++2e-===H2↑;总反应:Fe+2H+===Fe2++H2↑。(2)吸氧腐蚀:当铁钉表面的电解质溶液呈________或呈________并溶有O2时,将会发生吸氧腐蚀。负极:2Fe-4e-===2Fe2+;正极:2H2O+O2+4e-===4OH-;总反应:2Fe+2H2O+O2===2Fe(OH)2。铁锈(Fe2O3·xH2O)的形成:2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O。^2+OOH H2-|||-A-|||-水膜 - H2 bigcirc -|||-Cu Fe Cu-|||-表示 Fe^2+1化学腐蚀和电化学腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍,危害更大。2析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性,实际情况中以吸氧腐蚀为主。3钢铁发生析氢腐蚀或吸氧腐蚀时,负极都是铁,失电子生成Fe2+,而非Fe3+。^2+OOH H2-|||-A-|||-水膜 - H2 bigcirc -|||-Cu Fe Cu-|||-表示 Fe^2+例1^2+OOH H2-|||-A-|||-水膜 - H2 bigcirc -|||-Cu Fe Cu-|||-表示 Fe^2+下列关于金属腐蚀的说法正确的是()4e-===4OH-,正确;C项,若d为锌块,则由于金属活动性:Zn>Fe,Zn为原电池的负极,Fe为正极,首先被腐蚀的是Zn,Fe得到保护,铁片不易被腐蚀,正确;D项,d为锌块,由于电解质溶液为中性环境,发生的是吸氧腐蚀,在铁片上电极反应为:O2+2H2O+4e-===4OH-,错误。^2+OOH H2-|||-A-|||-水膜 - H2 bigcirc -|||-Cu Fe Cu-|||-表示 Fe^2+考点^2+OOH H2-|||-A-|||-水膜 - H2 bigcirc -|||-Cu Fe Cu-|||-表示 Fe^2+金属的腐蚀与防护^2+OOH H2-|||-A-|||-水膜 - H2 bigcirc -|||-Cu Fe Cu-|||-表示 Fe^2+题点^2+OOH H2-|||-A-|||-水膜 - H2 bigcirc -|||-Cu Fe Cu-|||-表示 Fe^2+金属腐蚀快慢的比较
钢铁的电化学腐蚀
根据钢铁表面水溶液薄膜的酸碱性不同,钢铁的电化学腐蚀分为析氢腐蚀和吸氧腐蚀。铜板上铁铆钉处的电化学腐蚀如下图所示:
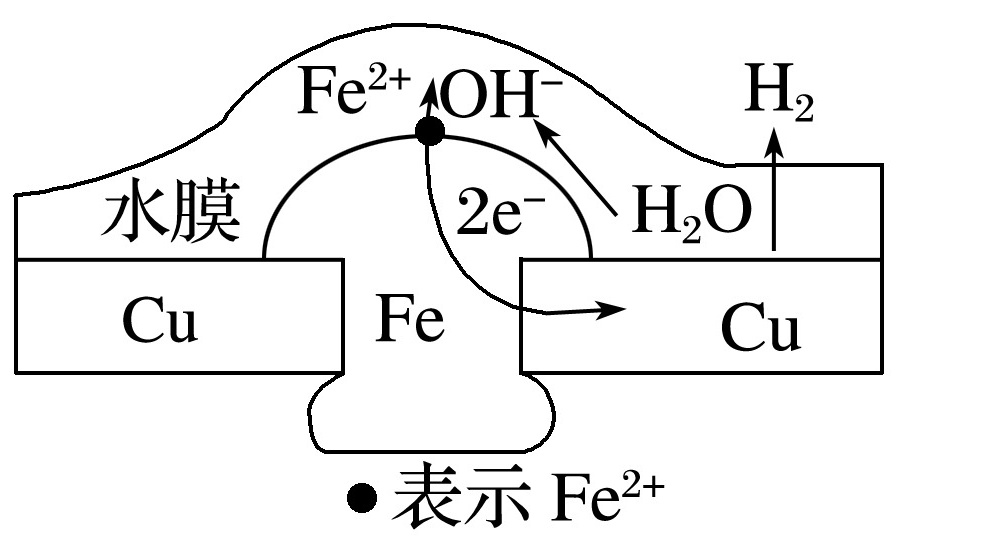
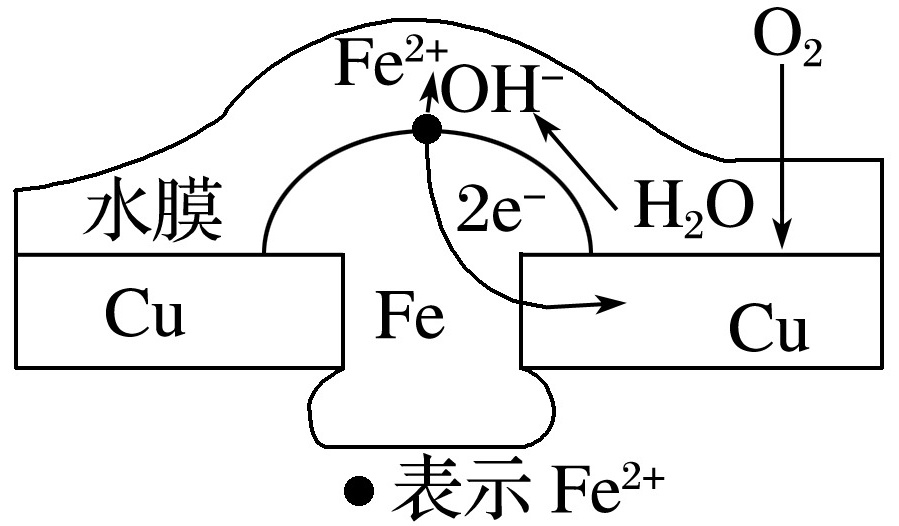
铁钉的析氢腐蚀示意图铁钉的吸氧腐蚀示意图
(1)析氢腐蚀:当铁钉表面的电解质溶液________较强时,腐蚀过程中有H2放出。
负极:Fe-2e-===Fe2+;
正极:2H++2e-===H2↑;
总反应:Fe+2H+===Fe2++H2↑。
(2)吸氧腐蚀:当铁钉表面的电解质溶液呈________或呈________并溶有O2时,将会发生吸氧腐蚀。
负极:2Fe-4e-===2Fe2+;
正极:2H2O+O2+4e-===4OH-;
总反应:2Fe+2H2O+O2===2Fe(OH)2。
铁锈(Fe2O3·xH2O)的形成:
2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O。

1化学腐蚀和电化学腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍,危害更大。
2析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性,实际情况中以吸氧腐蚀为主。
3钢铁发生析氢腐蚀或吸氧腐蚀时,负极都是铁,失电子生成Fe2+,而非Fe3+。
 例1
例1 下列关于金属腐蚀的说法正确的是()
下列关于金属腐蚀的说法正确的是()
4e-===4OH-,正确;C项,若d为锌块,则由于金属活动性:Zn>Fe,Zn为原电池的负极,Fe为正极,首先被腐蚀的是Zn,Fe得到保护,铁片不易被腐蚀,正确;D项,d为锌块,由于电解质溶液为中性环境,发生的是吸氧腐蚀,在铁片上电极反应为:O2+2H2O+4e-===4OH-,错误。
 考点
考点 金属的腐蚀与防护
金属的腐蚀与防护
 题点
题点 金属腐蚀快慢的比较
金属腐蚀快慢的比较
题目解答
答案
酸性 中性 弱酸性
解析
步骤 1:析氢腐蚀的条件
当铁钉表面的电解质溶液酸性较强时,腐蚀过程中有H2放出。这是因为酸性溶液中存在大量的H+离子,铁钉作为负极,失去电子生成Fe2+,而H+在正极得到电子生成H2。
步骤 2:吸氧腐蚀的条件
当铁钉表面的电解质溶液呈中性或弱酸性并溶有O2时,将会发生吸氧腐蚀。这是因为中性或弱酸性溶液中,O2作为氧化剂,铁钉作为负极,失去电子生成Fe2+,而O2在正极得到电子生成OH-。
步骤 3:铁锈的形成
铁锈(Fe2O3·xH2O)的形成是由于Fe(OH)2进一步氧化和脱水生成的。2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O。
当铁钉表面的电解质溶液酸性较强时,腐蚀过程中有H2放出。这是因为酸性溶液中存在大量的H+离子,铁钉作为负极,失去电子生成Fe2+,而H+在正极得到电子生成H2。
步骤 2:吸氧腐蚀的条件
当铁钉表面的电解质溶液呈中性或弱酸性并溶有O2时,将会发生吸氧腐蚀。这是因为中性或弱酸性溶液中,O2作为氧化剂,铁钉作为负极,失去电子生成Fe2+,而O2在正极得到电子生成OH-。
步骤 3:铁锈的形成
铁锈(Fe2O3·xH2O)的形成是由于Fe(OH)2进一步氧化和脱水生成的。2Fe(OH)3===Fe2O3·xH2O+(3-x)H2O。