题目
6.将下列化合物按碱性强弱排序。-|||-(1)吡啶、吡咯、六氢吡啶、苯胺-|||-(2)甲胺、苯胺、四氢吡咯、氨

题目解答
答案
解析
步骤 1:理解化合物的碱性
碱性是指化合物接受质子(H+)的能力。在有机化学中,碱性通常与氮原子的电子云密度有关。氮原子的电子云密度越高,其接受质子的能力越强,碱性越强。
步骤 2:分析化合物的结构
(1) 吡啶、吡咯、六氢吡啶、苯胺
- 吡啶:氮原子位于六元环上,环的共轭体系稳定了氮原子的电子云,碱性较弱。
- 吡咯:氮原子位于五元环上,环的共轭体系稳定了氮原子的电子云,碱性更弱。
- 六氢吡啶:氮原子位于六元环上,但环没有共轭体系,氮原子的电子云密度较高,碱性较强。
- 苯胺:氮原子直接与苯环相连,苯环的共轭体系稳定了氮原子的电子云,碱性较弱。
(2) 甲胺、苯胺、四氢吡咯、氨
- 甲胺:氮原子直接与甲基相连,甲基的供电子效应增加了氮原子的电子云密度,碱性较强。
- 苯胺:氮原子直接与苯环相连,苯环的共轭体系稳定了氮原子的电子云,碱性较弱。
- 四氢吡咯:氮原子位于五元环上,环没有共轭体系,氮原子的电子云密度较高,碱性较强。
- 氨:氮原子没有与任何基团相连,氮原子的电子云密度较高,碱性较强。
步骤 3:排序
(1) 吡啶、吡咯、六氢吡啶、苯胺
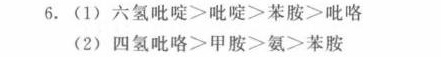
- 碱性由强到弱:六氢吡啶 > 吡啶 > 苯胺 > 吡咯
(2) 甲胺、苯胺、四氢吡咯、氨
- 碱性由强到弱:四氢吡咯 > 甲胺 > 氨 > 苯胺
碱性是指化合物接受质子(H+)的能力。在有机化学中,碱性通常与氮原子的电子云密度有关。氮原子的电子云密度越高,其接受质子的能力越强,碱性越强。
步骤 2:分析化合物的结构
(1) 吡啶、吡咯、六氢吡啶、苯胺
- 吡啶:氮原子位于六元环上,环的共轭体系稳定了氮原子的电子云,碱性较弱。
- 吡咯:氮原子位于五元环上,环的共轭体系稳定了氮原子的电子云,碱性更弱。
- 六氢吡啶:氮原子位于六元环上,但环没有共轭体系,氮原子的电子云密度较高,碱性较强。
- 苯胺:氮原子直接与苯环相连,苯环的共轭体系稳定了氮原子的电子云,碱性较弱。
(2) 甲胺、苯胺、四氢吡咯、氨
- 甲胺:氮原子直接与甲基相连,甲基的供电子效应增加了氮原子的电子云密度,碱性较强。
- 苯胺:氮原子直接与苯环相连,苯环的共轭体系稳定了氮原子的电子云,碱性较弱。
- 四氢吡咯:氮原子位于五元环上,环没有共轭体系,氮原子的电子云密度较高,碱性较强。
- 氨:氮原子没有与任何基团相连,氮原子的电子云密度较高,碱性较强。
步骤 3:排序
(1) 吡啶、吡咯、六氢吡啶、苯胺
- 碱性由强到弱:六氢吡啶 > 吡啶 > 苯胺 > 吡咯
(2) 甲胺、苯胺、四氢吡咯、氨
- 碱性由强到弱:四氢吡咯 > 甲胺 > 氨 > 苯胺