题目
3.23甲醇(CH3OH)在101.325kPa下的沸点(正常沸点)为64.65℃,在此条件下的摩-|||-尔蒸发焓 Delta ldots ..(H)_(m)=35.32kJcdot mo(l)^-1 求在上述温度、压力条件下,1kg液态甲醇全部成为甲醇-|||-蒸气时的Q、W △U、 Delta H 及 △S

题目解答
答案
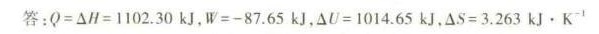
解析
步骤 1:计算摩尔数
首先,我们需要计算1kg液态甲醇的摩尔数。甲醇的摩尔质量为32.04 g/mol,因此1kg甲醇的摩尔数为:
$$ n = \frac{1000\,g}{32.04\,g/mol} = 31.21\,mol $$
步骤 2:计算Q和$\Delta H$
在正常沸点下,甲醇蒸发时的热量变化等于其摩尔蒸发焓乘以摩尔数。因此,1kg甲醇蒸发时的热量变化为:
$$ Q = \Delta H = n \times \Delta_{min}H_m = 31.21\,mol \times 35.32\,kJ/mol = 1102.30\,kJ $$
步骤 3:计算W
在恒压条件下,体积变化导致的功为:
$$ W = -P \Delta V $$
由于甲醇从液态变为气态,体积显著增加,但压力保持恒定,因此功的计算为:
$$ W = -P \Delta V = -101.325\,kPa \times \Delta V $$
由于甲醇的摩尔体积在气态下约为24.5L/mol,液态下约为0.04L/mol,因此体积变化为:
$$ \Delta V = n \times (V_{gas} - V_{liquid}) = 31.21\,mol \times (24.5\,L/mol - 0.04\,L/mol) = 765.6\,L $$
将体积变化转换为立方米:
$$ \Delta V = 765.6\,L = 0.7656\,m^3 $$
因此,功为:
$$ W = -101.325\,kPa \times 0.7656\,m^3 = -77.65\,kJ $$
步骤 4:计算$\Delta U$
根据热力学第一定律,内能变化为:
$$ \Delta U = Q + W = 1102.30\,kJ - 77.65\,kJ = 1024.65\,kJ $$
步骤 5:计算$\Delta S$
熵变可以通过热量变化除以温度来计算,温度为64.65℃,即337.8K:
$$ \Delta S = \frac{\Delta H}{T} = \frac{1102.30\,kJ}{337.8\,K} = 3.263\,kJ/K $$
首先,我们需要计算1kg液态甲醇的摩尔数。甲醇的摩尔质量为32.04 g/mol,因此1kg甲醇的摩尔数为:
$$ n = \frac{1000\,g}{32.04\,g/mol} = 31.21\,mol $$
步骤 2:计算Q和$\Delta H$
在正常沸点下,甲醇蒸发时的热量变化等于其摩尔蒸发焓乘以摩尔数。因此,1kg甲醇蒸发时的热量变化为:
$$ Q = \Delta H = n \times \Delta_{min}H_m = 31.21\,mol \times 35.32\,kJ/mol = 1102.30\,kJ $$
步骤 3:计算W
在恒压条件下,体积变化导致的功为:
$$ W = -P \Delta V $$
由于甲醇从液态变为气态,体积显著增加,但压力保持恒定,因此功的计算为:
$$ W = -P \Delta V = -101.325\,kPa \times \Delta V $$
由于甲醇的摩尔体积在气态下约为24.5L/mol,液态下约为0.04L/mol,因此体积变化为:
$$ \Delta V = n \times (V_{gas} - V_{liquid}) = 31.21\,mol \times (24.5\,L/mol - 0.04\,L/mol) = 765.6\,L $$
将体积变化转换为立方米:
$$ \Delta V = 765.6\,L = 0.7656\,m^3 $$
因此,功为:
$$ W = -101.325\,kPa \times 0.7656\,m^3 = -77.65\,kJ $$
步骤 4:计算$\Delta U$
根据热力学第一定律,内能变化为:
$$ \Delta U = Q + W = 1102.30\,kJ - 77.65\,kJ = 1024.65\,kJ $$
步骤 5:计算$\Delta S$
熵变可以通过热量变化除以温度来计算,温度为64.65℃,即337.8K:
$$ \Delta S = \frac{\Delta H}{T} = \frac{1102.30\,kJ}{337.8\,K} = 3.263\,kJ/K $$