题目
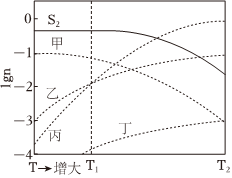
利用CaS循环再生可将燃煤尾气中的SO2转化生产单质硫,涉及的主要反应如下:Ⅰ.CaS(s)+2SO2(g)⇌CaSO4(s)+S2(g)ΔH1Ⅱ.CaSO4(s)+4H2(g)⇌CaS(s)+4H2O(g)ΔH2Ⅲ.SO2(g)+3H2(g)⇌H2S(g)+2H2O(g)ΔH3恒容条件下,按1mol CaS,1mol SO2和0.1mol H2投料反应。平衡体系中,各气态物种的lgn随温度的变化关系如图所示,n为气态物种物质的量的值。已知:图示温度范围内反应Ⅱ平衡常数K=108基本不变。0 S2-|||--1-|||-甲-|||--2|-|||-乙-|||-丙-|||-T→ 增大T1 T2回答下列问题:(1)反应4H2(g)+2SO2(g)⇌4H2O(g)+S2(g)的焓变ΔH= ____ (用含ΔH1、ΔH2的代数式表示)。(2)乙线所示物种为 ____ (填化学式)。反应Ⅲ的焓变ΔH3 ____ 0(填“>”“<”或“=”)。(3)T1温度下,体系达平衡时,乙线、丙线所示物种的物质的量相等,若丁线所示物种为amol,则S2为 ____ mol(用含a的代数式表示);此时,CaS与CaSO4物质的量的差值n(CaS)-n(CaSO4)= ____ mol(用含a的最简代数式表示)。(4)T2温度下,体系达平衡后,压缩容器体积S2产率增大。与压缩前相比,重新达平衡时,H2S与H2物质的量之比(n((H)_(2)S))/(n((H)_{2))} ____ (填“增大”“减小”或“不变”),H2O物质的量n(H2O) ____ (填“增大”“减小”或“不变”)
利用CaS循环再生可将燃煤尾气中的SO2转化生产单质硫,涉及的主要反应如下:
Ⅰ.CaS(s)+2SO2(g)⇌CaSO4(s)+S2(g)ΔH1
Ⅱ.CaSO4(s)+4H2(g)⇌CaS(s)+4H2O(g)ΔH2
Ⅲ.SO2(g)+3H2(g)⇌H2S(g)+2H2O(g)ΔH3
恒容条件下,按1mol CaS,1mol SO2和0.1mol H2投料反应。平衡体系中,各气态物种的lgn随温度的变化关系如图所示,n为气态物种物质的量的值。
已知:图示温度范围内反应Ⅱ平衡常数K=108基本不变。
回答下列问题:
(1)反应4H2(g)+2SO2(g)⇌4H2O(g)+S2(g)的焓变ΔH= ____ (用含ΔH1、ΔH2的代数式表示)。
(2)乙线所示物种为 ____ (填化学式)。反应Ⅲ的焓变ΔH3 ____ 0(填“>”“<”或“=”)。
(3)T1温度下,体系达平衡时,乙线、丙线所示物种的物质的量相等,若丁线所示物种为amol,则S2为 ____ mol(用含a的代数式表示);此时,CaS与CaSO4物质的量的差值n(CaS)-n(CaSO4)= ____ mol(用含a的最简代数式表示)。
(4)T2温度下,体系达平衡后,压缩容器体积S2产率增大。与压缩前相比,重新达平衡时,H2S与H2物质的量之比$\frac{n({H}_{2}S)}{n({H}_{2})}$ ____ (填“增大”“减小”或“不变”),H2O物质的量n(H2O) ____ (填“增大”“减小”或“不变”)
Ⅰ.CaS(s)+2SO2(g)⇌CaSO4(s)+S2(g)ΔH1
Ⅱ.CaSO4(s)+4H2(g)⇌CaS(s)+4H2O(g)ΔH2
Ⅲ.SO2(g)+3H2(g)⇌H2S(g)+2H2O(g)ΔH3
恒容条件下,按1mol CaS,1mol SO2和0.1mol H2投料反应。平衡体系中,各气态物种的lgn随温度的变化关系如图所示,n为气态物种物质的量的值。
已知:图示温度范围内反应Ⅱ平衡常数K=108基本不变。

回答下列问题:
(1)反应4H2(g)+2SO2(g)⇌4H2O(g)+S2(g)的焓变ΔH= ____ (用含ΔH1、ΔH2的代数式表示)。
(2)乙线所示物种为 ____ (填化学式)。反应Ⅲ的焓变ΔH3 ____ 0(填“>”“<”或“=”)。
(3)T1温度下,体系达平衡时,乙线、丙线所示物种的物质的量相等,若丁线所示物种为amol,则S2为 ____ mol(用含a的代数式表示);此时,CaS与CaSO4物质的量的差值n(CaS)-n(CaSO4)= ____ mol(用含a的最简代数式表示)。
(4)T2温度下,体系达平衡后,压缩容器体积S2产率增大。与压缩前相比,重新达平衡时,H2S与H2物质的量之比$\frac{n({H}_{2}S)}{n({H}_{2})}$ ____ (填“增大”“减小”或“不变”),H2O物质的量n(H2O) ____ (填“增大”“减小”或“不变”)
题目解答
答案
(1)根据盖斯定律,Ⅰ+Ⅱ,可得,4H2(g)+2SO2(g)⇌4H2O(g)+S2(g) ΔH=ΔH1+ΔH2,
故答案为:ΔH1+ΔH2;
(2)图示温度范围内反应Ⅱ平衡常数K=108基本不变,即K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$=108,则$\frac{c({H}_{2}O)}{c({H}_{2})}$=102,lg$\frac{c({H}_{2}O)}{c({H}_{2})}$=2,由图像可知,曲线乙代表H2O,丁代表H2;曲线甲代表H2S,由图可知,随温度升高,c(H2S)减小,反应Ⅲ逆向移动,说明反应Ⅲ为放热反应,即ΔH3<0,
故答案为:H2O;<;
(3)由题意知,丁线所示物种为amol,即n(H2)=amol,则n(H2O)=100amol,n(SO2)=100amol,根据H守恒,则n(H2S)=(0.1-a-100a)mol=(0.1-101a)mol,根据S守恒可求得n(S2)=$\frac{1}{2}$[1-(100a+0.1+101a)]mol=$\frac{1}{2}$(0.9+a)mol;根据O守恒,n(CaSO4)=$\frac{1}{4}$×(2-100a-200a)mol=$\frac{1}{4}$×(2-300a)mol,根据固态S守恒,可得n(CaS)=[1-$\frac{1}{4}$×(2-300a)]mol,CaS与CaSO4物质的量的差值n(CaS)-n(CaSO4)=[1-$\frac{1}{4}$×(2-300a)]mol-$\frac{1}{4}$×(2-300a)mol=150a,
故答案为:$\frac{1}{2}$(0.9+a);150a;
(4)K3=$\frac{c({H}_{2}S)×{c}^{2}({H}_{2}O)}{c(S{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{c({H}_{2}S)}{c({H}_{2})}$×$\frac{{c}^{2}({H}_{2}O)}{{c}^{2}({H}_{2})}$×$\frac{1}{c(S{O}_{2})}$,T2温度下,体系达平衡后,压缩容器体积S2产率增大,反应1正向移动,c(SO2)增大,$\frac{{c}^{2}({H}_{2}O)}{{c}^{2}({H}_{2})}$为定值,K3为定值,则$\frac{c({H}_{2}S)}{c({H}_{2})}$增大;根据H守恒,则n(H2S)+n(H2O)+n(H2)=0.1mol,即n(H2S)+1.01×n(H2O)=0.1mol,压强增大,反应Ⅲ正向移动,n(H2S)增大,则n(H2O)减小,
故答案为:增大;减小。
故答案为:ΔH1+ΔH2;
(2)图示温度范围内反应Ⅱ平衡常数K=108基本不变,即K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$=108,则$\frac{c({H}_{2}O)}{c({H}_{2})}$=102,lg$\frac{c({H}_{2}O)}{c({H}_{2})}$=2,由图像可知,曲线乙代表H2O,丁代表H2;曲线甲代表H2S,由图可知,随温度升高,c(H2S)减小,反应Ⅲ逆向移动,说明反应Ⅲ为放热反应,即ΔH3<0,
故答案为:H2O;<;
(3)由题意知,丁线所示物种为amol,即n(H2)=amol,则n(H2O)=100amol,n(SO2)=100amol,根据H守恒,则n(H2S)=(0.1-a-100a)mol=(0.1-101a)mol,根据S守恒可求得n(S2)=$\frac{1}{2}$[1-(100a+0.1+101a)]mol=$\frac{1}{2}$(0.9+a)mol;根据O守恒,n(CaSO4)=$\frac{1}{4}$×(2-100a-200a)mol=$\frac{1}{4}$×(2-300a)mol,根据固态S守恒,可得n(CaS)=[1-$\frac{1}{4}$×(2-300a)]mol,CaS与CaSO4物质的量的差值n(CaS)-n(CaSO4)=[1-$\frac{1}{4}$×(2-300a)]mol-$\frac{1}{4}$×(2-300a)mol=150a,
故答案为:$\frac{1}{2}$(0.9+a);150a;
(4)K3=$\frac{c({H}_{2}S)×{c}^{2}({H}_{2}O)}{c(S{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{c({H}_{2}S)}{c({H}_{2})}$×$\frac{{c}^{2}({H}_{2}O)}{{c}^{2}({H}_{2})}$×$\frac{1}{c(S{O}_{2})}$,T2温度下,体系达平衡后,压缩容器体积S2产率增大,反应1正向移动,c(SO2)增大,$\frac{{c}^{2}({H}_{2}O)}{{c}^{2}({H}_{2})}$为定值,K3为定值,则$\frac{c({H}_{2}S)}{c({H}_{2})}$增大;根据H守恒,则n(H2S)+n(H2O)+n(H2)=0.1mol,即n(H2S)+1.01×n(H2O)=0.1mol,压强增大,反应Ⅲ正向移动,n(H2S)增大,则n(H2O)减小,
故答案为:增大;减小。