题目
7.当NO2被冷却到室温时,发生聚合反应:-|||-(O)_(2)(g)arrow (N)_(2)(O)_(4)(g)-|||-若在高温下将15.2g NO2充入10.0L的容器中,然后使其冷却到25℃。测得总压为-|||-0.500atm。试计算NO2(g)和N2O4(g)的摩尔分数和分压。

题目解答
答案
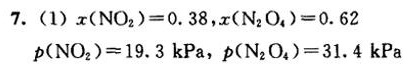
解析
考查要点:本题主要考查化学平衡的计算,涉及理想气体状态方程的应用及分压、摩尔分数的计算。
解题核心思路:
- 设定变量:根据反应式,设生成的N₂O₄物质的量为$x$,则消耗的NO₂为$2x$,建立平衡时各物质的量表达式。
- 总物质的量与总压强关系:利用理想气体状态方程$PV = nRT$,结合总压强和已知条件,建立方程求解$x$。
- 计算分压与摩尔分数:通过平衡时各物质的量占总物质的量的比例,计算摩尔分数,再结合总压强得到分压。
破题关键点:
- 正确设定变量,明确反应前后物质的量变化关系。
- 灵活运用理想气体状态方程,将总压强与总物质的量关联。
- 分压与摩尔分数的转换关系:分压等于总压强乘以摩尔分数。
步骤1:计算初始NO₂的物质的量
NO₂的摩尔质量为$46 \, \text{g/mol}$,则初始物质的量为:
$n_{\text{NO}_2,\text{初始}} = \frac{15.2}{46} \approx 0.3304 \, \text{mol}.$
步骤2:设定变量并建立平衡关系
设反应生成$x \, \text{mol}$的N₂O₄,则消耗$2x \, \text{mol}$的NO₂。平衡时:
- $n_{\text{NO}_2} = 0.3304 - 2x$,
- $n_{\text{N}_2\text{O}_4} = x$,
- 总物质的量$n_{\text{总}} = (0.3304 - 2x) + x = 0.3304 - x$。
步骤3:利用理想气体方程求$x$
总压强为$0.500 \, \text{atm}$,体积$V = 10.0 \, \text{L}$,温度$T = 298 \, \text{K}$,代入理想气体方程:
$P_{\text{总}} V = n_{\text{总}} R T \implies 0.500 \times 10.0 = (0.3304 - x) \times 0.0821 \times 298.$
计算得:
$0.3304 - x \approx 0.2043 \implies x \approx 0.1261 \, \text{mol}.$
步骤4:计算平衡时各物质的量
- $n_{\text{NO}_2} = 0.3304 - 2 \times 0.1261 \approx 0.0782 \, \text{mol}$,
- $n_{\text{N}_2\text{O}_4} = 0.1261 \, \text{mol}$,
- 总物质的量$n_{\text{总}} = 0.0782 + 0.1261 \approx 0.2043 \, \text{mol}$。
步骤5:计算摩尔分数
- $x(\text{NO}_2) = \frac{0.0782}{0.2043} \approx 0.38$,
- $x(\text{N}_2\text{O}_4) = \frac{0.1261}{0.2043} \approx 0.62$。
步骤6:计算分压
总压强为$0.500 \, \text{atm}$,分压为:
- $p(\text{NO}_2) = 0.38 \times 0.500 \, \text{atm} \approx 0.1915 \, \text{atm} \approx 19.3 \, \text{kPa}$,
- $p(\text{N}_2\text{O}_4) = 0.62 \times 0.500 \, \text{atm} \approx 0.310 \, \text{atm} \approx 31.4 \, \text{kPa}$。