有一原电池Ag | AgCl(s) | Cl-(a=1)||Cu2+(a=0、01)| Cu。(1)写出上述原电池的反应式;(2)计算该原电池在25℃时的电动势E;(3)25℃时,原电池反应的 吉布斯函数变(rG m)与平衡常数K各为多少?已知:E(Cu2+|Cu) = 0、3402V,E(Cl-|AgCl|Ag) =0、2223 V。
有一原电池Ag | AgCl(s) | Cl-(a=1)||Cu2+(a=0、01)| Cu。
(1)写出上述原电池的反应式;
(2)计算该原电池在25℃时的电动势E;
(3)25℃时,原电池反应的 吉布斯函数变(rG m)与平衡常数K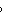 各为多少?
各为多少?
已知:E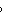 (Cu2+|Cu) = 0、3402V,E
(Cu2+|Cu) = 0、3402V,E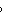 (Cl-|AgCl|Ag) =0、2223 V。
(Cl-|AgCl|Ag) =0、2223 V。
题目解答
答案
解: (1)2Ag+2Cl-(a=1) + Cu2+(a=0、01) ==== 2AgCl(s) + Cu
(2)E=[0、3402-0、2223-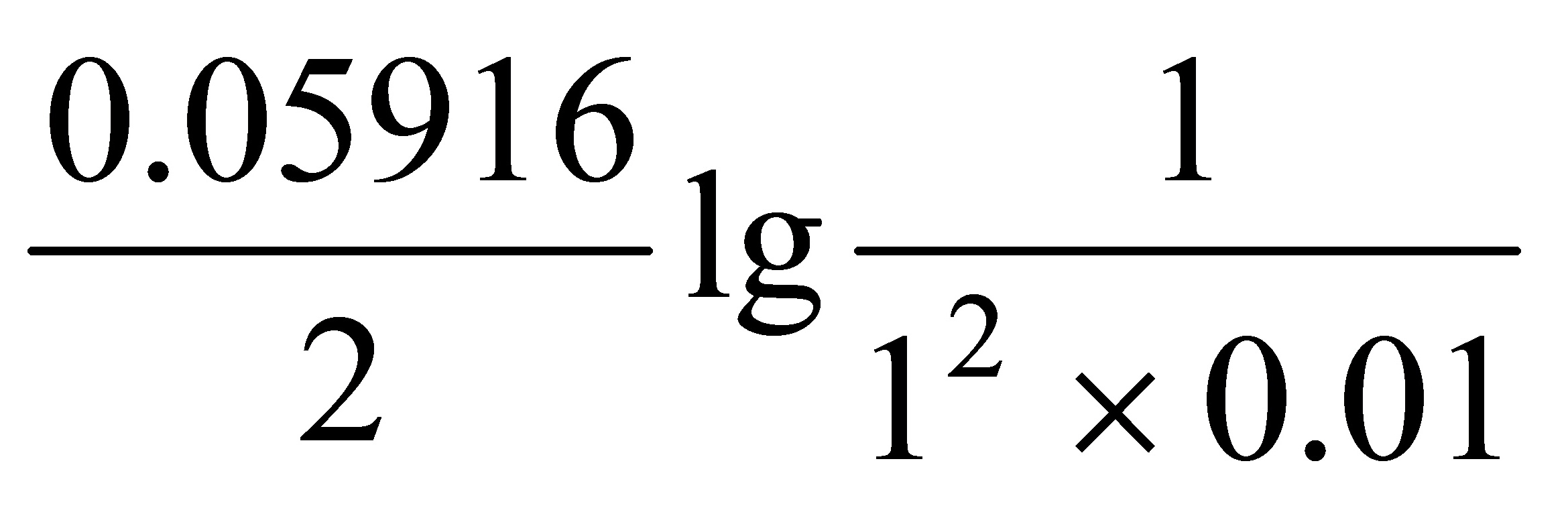 ] V = 0、05875 V
] V = 0、05875 V
(3)rG m=-zFE=[-2×96485×0、05875] J·mol-1=-11、337 kJ·mol-1
rG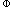 =-zFE
=-zFE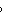 =-RTlnK
=-RTlnK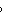
lnK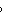 =-zFE
=-zFE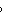 /RT=
/RT=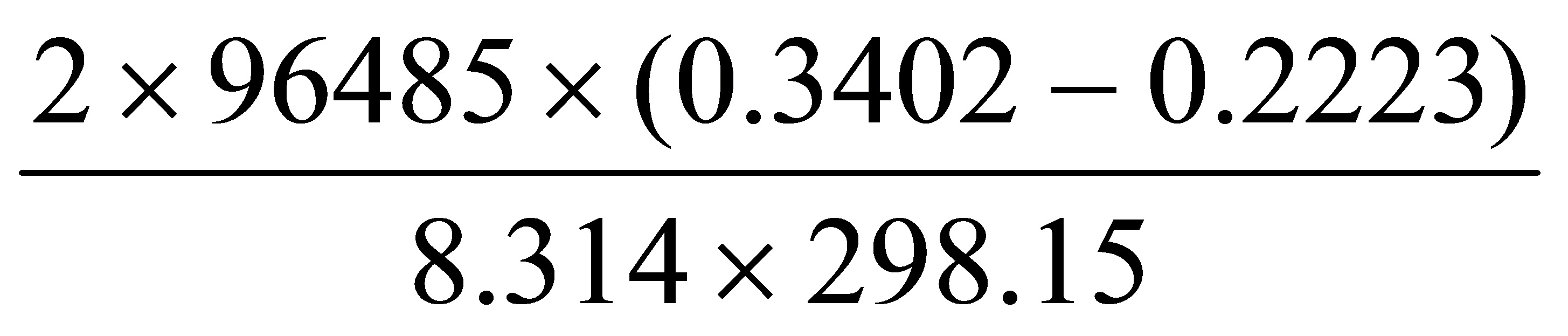 =9、1782
=9、1782
K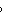 =9、68×103
=9、68×103
解析
考查要点:本题主要考查原电池反应式的书写、电动势的计算以及吉布斯函数变与平衡常数的关系。
解题思路:
- 确定正负极:根据标准电极电势,正极为电势高的Cu²+/Cu,负极为电势低的AgCl/Ag。
- 书写半反应:负极Ag被氧化生成AgCl,正极Cu²+被还原为Cu,结合电子守恒写出总反应。
- 电动势计算:利用Nernst方程分别计算两极实际电势,再求差。
- 热力学关系:通过电动势计算ΔG,再通过ΔG°与平衡常数K的关系求解。
第(1)题
负极反应:
$\text{Ag(s)} + \text{Cl}^- \rightarrow \text{AgCl(s)} + e^-$
正极反应:
$\text{Cu}^{2+} + 2e^- \rightarrow \text{Cu(s)}$
总反应:将两式相加,得:
$2\text{Ag} + 2\text{Cl}^- + \text{Cu}^{2+} \rightarrow 2\text{AgCl(s)} + \text{Cu(s)}$
第(2)题
计算正极电势
$E_{\text{正}} = E^\circ_{\text{Cu}^{2+}|\text{Cu}} + \frac{0.05916}{2} \lg \frac{1}{[\text{Cu}^{2+}]}$
代入数据:
$E_{\text{正}} = 0.3402 - \frac{0.05916}{2} \lg \frac{1}{0.01} = 0.3402 - 0.05916 = 0.28104 \, \text{V}$
计算负极电势
因$\text{Cl}^-$活度为1,负极电势保持标准值:
$E_{\text{负}} = E^\circ_{\text{Cl}^-|\text{AgCl}|\text{Ag}} = 0.2223 \, \text{V}$
原电池电动势
$E = E_{\text{正}} - E_{\text{负}} = 0.28104 - 0.2223 = 0.05874 \, \text{V}$
第(3)题
吉布斯函数变
$\Delta G_m = -zFE = -2 \times 96485 \times 0.05875 = -11337 \, \text{J/mol} = -11.337 \, \text{kJ/mol}$
平衡常数
标准吉布斯函数变:
$\Delta G^\circ = -zFE^\circ = -2 \times 96485 \times (0.3402 - 0.2223) = -22730 \, \text{J/mol}$
计算$\ln K$:
$\ln K = -\frac{\Delta G^\circ}{RT} = \frac{22730}{8.314 \times 298.15} \approx 9.178$
求$K$:
$K = e^{9.178} \approx 9.68 \times 10^3$