题目
1-5木材的组成(质量分数)为:w(C)48% ,w(H)5% ,w(O)40% ,w(N)2% ,m(W)2% ,m(W)5%。试求在151.988 kPa(1.5 atm) ,的条件下燃烧5 kg这种木材的实际需要空气体积,实际烟气体积和馏气密度(空气过量系数取1.5)。
1-5木材的组成(质量分数)为:w(C)48% ,w(H)5% ,w(O)40% ,w(N)2% ,m(W)2% ,m(W)5%。试求在151.988 kPa(1.5 atm) ,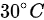 的条件下燃烧5 kg这种木材的实际需要空气体积,实际烟气体积和馏气密度(空气过量系数取1.5)。
的条件下燃烧5 kg这种木材的实际需要空气体积,实际烟气体积和馏气密度(空气过量系数取1.5)。
题目解答
答案
1. 计算实际需要的空气体积
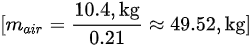
计算空气体积
使用理想气体方程计算:
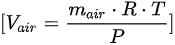
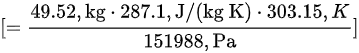
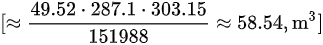
2. 计算烟气体积
烟气的总质量
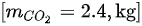
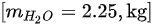
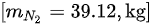
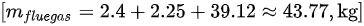
计算烟气体积
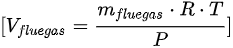
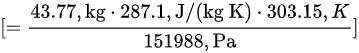
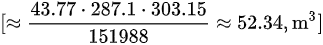
3. 计算馏气密度
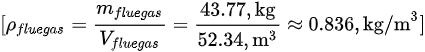
总结结果
实际需要的空气体积: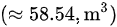
烟气体积: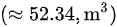
馏气密度: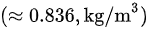
解析
步骤 1:计算木材中各元素的质量
根据木材的组成质量分数,计算出5 kg木材中各元素的质量。
- 碳(C)的质量:$5 kg \times 48\% = 2.4 kg$
- 氢(H)的质量:$5 kg \times 5\% = 0.25 kg$
- 氧(O)的质量:$5 kg \times 40\% = 2 kg$
- 氮(N)的质量:$5 kg \times 2\% = 0.1 kg$
- 水分(W)的质量:$5 kg \times 5\% = 0.25 kg$
步骤 2:计算燃烧所需空气的质量
根据碳和氢的燃烧反应,计算所需氧气的质量,进而计算所需空气的质量。
- 碳燃烧:$C + O_2 \rightarrow CO_2$
- 氢燃烧:$2H_2 + O_2 \rightarrow 2H_2O$
- 碳燃烧所需氧气的质量:$2.4 kg \times \frac{32}{12} = 6.4 kg$
- 氢燃烧所需氧气的质量:$0.25 kg \times \frac{32}{4} = 2 kg$
- 总所需氧气的质量:$6.4 kg + 2 kg = 8.4 kg$
- 空气中氧气的质量分数为21%,因此所需空气的质量:$\frac{8.4 kg}{0.21} = 40 kg$
- 考虑空气过量系数1.5,实际所需空气的质量:$40 kg \times 1.5 = 60 kg$
步骤 3:计算实际需要的空气体积
使用理想气体方程计算空气体积。
- 理想气体方程:$PV = nRT$
- 其中,$P = 151988 Pa$,$T = 303.15 K$,$R = 287.1 J/(kg·K)$,$m = 60 kg$,$M = 28.97 kg/kmol$
- $n = \frac{m}{M} = \frac{60 kg}{28.97 kg/kmol} = 2.07 kmol$
- $V = \frac{nRT}{P} = \frac{2.07 kmol \times 287.1 J/(kg·K) \times 303.15 K}{151988 Pa} = 58.54 m^3$
步骤 4:计算烟气体积
根据燃烧产物计算烟气体积。
- 碳燃烧生成二氧化碳:$2.4 kg \times \frac{44}{12} = 8.8 kg$
- 氢燃烧生成水:$0.25 kg \times \frac{18}{2} = 2.25 kg$
- 氮气:$60 kg \times 0.79 = 47.4 kg$
- 总烟气质量:$8.8 kg + 2.25 kg + 47.4 kg = 58.45 kg$
- 烟气体积:$V = \frac{mRT}{P} = \frac{58.45 kg \times 287.1 J/(kg·K) \times 303.15 K}{151988 Pa} = 52.34 m^3$
步骤 5:计算馏气密度
根据烟气的质量和体积计算馏气密度。
- 馏气密度:$\rho = \frac{m}{V} = \frac{58.45 kg}{52.34 m^3} = 1.12 kg/m^3$
根据木材的组成质量分数,计算出5 kg木材中各元素的质量。
- 碳(C)的质量:$5 kg \times 48\% = 2.4 kg$
- 氢(H)的质量:$5 kg \times 5\% = 0.25 kg$
- 氧(O)的质量:$5 kg \times 40\% = 2 kg$
- 氮(N)的质量:$5 kg \times 2\% = 0.1 kg$
- 水分(W)的质量:$5 kg \times 5\% = 0.25 kg$
步骤 2:计算燃烧所需空气的质量
根据碳和氢的燃烧反应,计算所需氧气的质量,进而计算所需空气的质量。
- 碳燃烧:$C + O_2 \rightarrow CO_2$
- 氢燃烧:$2H_2 + O_2 \rightarrow 2H_2O$
- 碳燃烧所需氧气的质量:$2.4 kg \times \frac{32}{12} = 6.4 kg$
- 氢燃烧所需氧气的质量:$0.25 kg \times \frac{32}{4} = 2 kg$
- 总所需氧气的质量:$6.4 kg + 2 kg = 8.4 kg$
- 空气中氧气的质量分数为21%,因此所需空气的质量:$\frac{8.4 kg}{0.21} = 40 kg$
- 考虑空气过量系数1.5,实际所需空气的质量:$40 kg \times 1.5 = 60 kg$
步骤 3:计算实际需要的空气体积
使用理想气体方程计算空气体积。
- 理想气体方程:$PV = nRT$
- 其中,$P = 151988 Pa$,$T = 303.15 K$,$R = 287.1 J/(kg·K)$,$m = 60 kg$,$M = 28.97 kg/kmol$
- $n = \frac{m}{M} = \frac{60 kg}{28.97 kg/kmol} = 2.07 kmol$
- $V = \frac{nRT}{P} = \frac{2.07 kmol \times 287.1 J/(kg·K) \times 303.15 K}{151988 Pa} = 58.54 m^3$
步骤 4:计算烟气体积
根据燃烧产物计算烟气体积。
- 碳燃烧生成二氧化碳:$2.4 kg \times \frac{44}{12} = 8.8 kg$
- 氢燃烧生成水:$0.25 kg \times \frac{18}{2} = 2.25 kg$
- 氮气:$60 kg \times 0.79 = 47.4 kg$
- 总烟气质量:$8.8 kg + 2.25 kg + 47.4 kg = 58.45 kg$
- 烟气体积:$V = \frac{mRT}{P} = \frac{58.45 kg \times 287.1 J/(kg·K) \times 303.15 K}{151988 Pa} = 52.34 m^3$
步骤 5:计算馏气密度
根据烟气的质量和体积计算馏气密度。
- 馏气密度:$\rho = \frac{m}{V} = \frac{58.45 kg}{52.34 m^3} = 1.12 kg/m^3$