题目
在298K的等温情况下,在一个中间有导热隔板分开的盒子中,一边放0.2molO2(g),压力为20kPa,另一边放0.8molN2(g),压力为80kPa,抽去隔板使两种气体混合,试求(1)混合后盒子中的压力;(2)混合过程的Q,W,△U,△S和△G;(3)如果假设在等温情况下,使混合后的气体再可逆地回到始态,计算该过程的Q和W的值。
在298K的等温情况下,在一个中间有导热隔板分开的盒子中,一边放0.2molO2(g),压力为20kPa,另一边放0.8molN2(g),压力为80kPa,抽去隔板使两种气体混合,试求
(1)混合后盒子中的压力;
(2)混合过程的Q,W,△U,△S和△G;
(3)如果假设在等温情况下,使混合后的气体再可逆地回到始态,计算该过程的Q和W的值。
题目解答
答案
解:(1)混合前O2(g)和N2(g)的体积V相等,混合后是1mol气体占全部容积的体积2V。
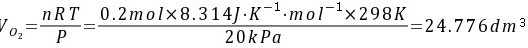
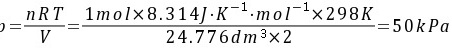
(2)由于是等温过程 △U=0
O2(g)和N2(g)都相当于在等温下从V膨胀到2V
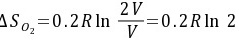
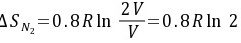
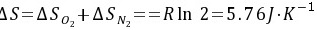
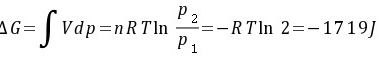
(3)因为△U′=0,Qr=-Wr=T△S′
所以 Qr=-Wr=T△S′=298K×(-5.76J•K-1)=-1.716J
解析
步骤 1:计算混合后盒子中的压力
混合前,O2(g)和N2(g)的体积V相等,混合后是1mol气体占全部容积的体积2V。根据理想气体状态方程,混合后的压力为:
$$
p = \frac{nRT}{V} = \frac{1mol \times 8.314 J\cdot mol^{-1}\cdot K^{-1} \times 298K}{24.776 dm^3 \times 2} = 50kPa
$$
步骤 2:计算混合过程的Q, W, △U, △S和△G
由于是等温过程,△U=0。O2(g)和N2(g)都相当于在等温下从V膨胀到2V,因此:
$$
\Delta S_{O_2} = 0.2R\ln \frac{2V}{V} = 0.2R\ln 2
$$
$$
\Delta S_{N_2} = 0.8R\ln \frac{2V}{V} = 0.8R\ln 2
$$
$$
\Delta S = \Delta S_{O_2} + \Delta S_{N_2} = R\ln 2 = 5.76 J\cdot K^{-1}
$$
$$
\Delta G = \int vdp = nRT\ln \frac{p_2}{p_1} = -RT\ln 2 = -1719 J
$$
步骤 3:计算可逆回到始态的Q和W的值
因为△U′=0,Qr=-Wr=T△S′,所以:
$$
Qr = -Wr = T\Delta S' = 298K \times (-5.76 J\cdot K^{-1}) = -1.716 J
$$
混合前,O2(g)和N2(g)的体积V相等,混合后是1mol气体占全部容积的体积2V。根据理想气体状态方程,混合后的压力为:
$$
p = \frac{nRT}{V} = \frac{1mol \times 8.314 J\cdot mol^{-1}\cdot K^{-1} \times 298K}{24.776 dm^3 \times 2} = 50kPa
$$
步骤 2:计算混合过程的Q, W, △U, △S和△G
由于是等温过程,△U=0。O2(g)和N2(g)都相当于在等温下从V膨胀到2V,因此:
$$
\Delta S_{O_2} = 0.2R\ln \frac{2V}{V} = 0.2R\ln 2
$$
$$
\Delta S_{N_2} = 0.8R\ln \frac{2V}{V} = 0.8R\ln 2
$$
$$
\Delta S = \Delta S_{O_2} + \Delta S_{N_2} = R\ln 2 = 5.76 J\cdot K^{-1}
$$
$$
\Delta G = \int vdp = nRT\ln \frac{p_2}{p_1} = -RT\ln 2 = -1719 J
$$
步骤 3:计算可逆回到始态的Q和W的值
因为△U′=0,Qr=-Wr=T△S′,所以:
$$
Qr = -Wr = T\Delta S' = 298K \times (-5.76 J\cdot K^{-1}) = -1.716 J
$$