题目
15.298K时,某水溶液中含有 ^2+ 和 ^2+, 两者质量摩尔浓度都是 .5molcdot (kg)^-1, 此-|||-溶液的pH值为5。现在用Ni(s)作阴极来电解,已知 _(c{d)^2}+|cd=-0.402V _(2n)+(I)_(n)=-0.763V,-|||-H2在Ni、Cd、Zn上的超电势分别为0.14 V,0.48V和0.70V。试计算:-|||-(1)在Ni(s)阴极上依次析出什么物质?-|||-(2)当第二种物质析出时,第一种物质的离子的剩余质量摩尔浓度为多少?(设溶液的-|||-pH值在电解过程中不因第一种离子的析出而改变)

题目解答
答案
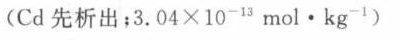
解析
步骤 1:确定析出顺序
首先,根据标准电极电势,Cd²⁺和Zn²⁺的析出电势分别为-0.402V和-0.763V。由于Cd²⁺的析出电势比Zn²⁺的析出电势更正,因此在Ni(s)阴极上,Cd²⁺会先于Zn²⁺析出。H₂的析出电势为0V,但考虑到超电势,H₂的析出电势变为0.14V,因此H₂不会在Cd²⁺和Zn²⁺析出之前析出。
步骤 2:计算Cd²⁺析出时的电势
Cd²⁺析出时的电势为:
\[ E_{Cd^{2+}/Cd} = E_{Cd^{2+}/Cd}^{\circ} + \frac{0.0592}{2} \log [Cd^{2+}] \]
由于Cd²⁺的初始浓度为0.5 mol/kg,代入计算得:
\[ E_{Cd^{2+}/Cd} = -0.402 + \frac{0.0592}{2} \log 0.5 = -0.402 - 0.0296 = -0.4316V \]
步骤 3:计算Zn²⁺析出时的电势
Zn²⁺析出时的电势为:
\[ E_{Zn^{2+}/Zn} = E_{Zn^{2+}/Zn}^{\circ} + \frac{0.0592}{2} \log [Zn^{2+}] \]
由于Zn²⁺的初始浓度为0.5 mol/kg,代入计算得:
\[ E_{Zn^{2+}/Zn} = -0.763 + \frac{0.0592}{2} \log 0.5 = -0.763 - 0.0296 = -0.7926V \]
步骤 4:计算Cd²⁺析出时的剩余浓度
当Zn²⁺开始析出时,Cd²⁺的析出电势应等于Zn²⁺的析出电势,即:
\[ E_{Cd^{2+}/Cd} = E_{Zn^{2+}/Zn} \]
代入计算得:
\[ -0.402 + \frac{0.0592}{2} \log [Cd^{2+}] = -0.7926 \]
解得:
\[ \log [Cd^{2+}] = \frac{-0.7926 + 0.402}{0.0296} = -12.51 \]
\[ [Cd^{2+}] = 10^{-12.51} = 3.04 \times 10^{-13} mol/kg \]
首先,根据标准电极电势,Cd²⁺和Zn²⁺的析出电势分别为-0.402V和-0.763V。由于Cd²⁺的析出电势比Zn²⁺的析出电势更正,因此在Ni(s)阴极上,Cd²⁺会先于Zn²⁺析出。H₂的析出电势为0V,但考虑到超电势,H₂的析出电势变为0.14V,因此H₂不会在Cd²⁺和Zn²⁺析出之前析出。
步骤 2:计算Cd²⁺析出时的电势
Cd²⁺析出时的电势为:
\[ E_{Cd^{2+}/Cd} = E_{Cd^{2+}/Cd}^{\circ} + \frac{0.0592}{2} \log [Cd^{2+}] \]
由于Cd²⁺的初始浓度为0.5 mol/kg,代入计算得:
\[ E_{Cd^{2+}/Cd} = -0.402 + \frac{0.0592}{2} \log 0.5 = -0.402 - 0.0296 = -0.4316V \]
步骤 3:计算Zn²⁺析出时的电势
Zn²⁺析出时的电势为:
\[ E_{Zn^{2+}/Zn} = E_{Zn^{2+}/Zn}^{\circ} + \frac{0.0592}{2} \log [Zn^{2+}] \]
由于Zn²⁺的初始浓度为0.5 mol/kg,代入计算得:
\[ E_{Zn^{2+}/Zn} = -0.763 + \frac{0.0592}{2} \log 0.5 = -0.763 - 0.0296 = -0.7926V \]
步骤 4:计算Cd²⁺析出时的剩余浓度
当Zn²⁺开始析出时,Cd²⁺的析出电势应等于Zn²⁺的析出电势,即:
\[ E_{Cd^{2+}/Cd} = E_{Zn^{2+}/Zn} \]
代入计算得:
\[ -0.402 + \frac{0.0592}{2} \log [Cd^{2+}] = -0.7926 \]
解得:
\[ \log [Cd^{2+}] = \frac{-0.7926 + 0.402}{0.0296} = -12.51 \]
\[ [Cd^{2+}] = 10^{-12.51} = 3.04 \times 10^{-13} mol/kg \]