题目
对于金属材料,我们应从多角度了解。【金属材料】2023年5月,我国自主研制的C919大型客机成功完成首次商业载客飞行。国产大飞机翱翔蓝天,承载着国家意志、民族梦想和人民期盼。(1)C919的机身采用了第三代铝锂合金,铝锂合金属于 ____ (填“金属材料”或“合成材料”)。(2)飞机起落架是我国自主研发生产的合金钢。用合金钢制造起落架主要是利用其 ____ (写出一点即可)和耐腐蚀等性能。【金属的性质】(3)在常温下,铝制品耐腐蚀的原因为 ____ 。(4)如图所示实验,先向a中加入过量 ____ 充分反应后打开弹簧夹;使a中溶液个部进入b中,铜片表面没有变化,由此可证明铁、铜的金属活动性顺序以及与氢的位置关系为Fe>H>Cu。?-|||-铁片-|||-K-|||-时 铜片(5)将铝丝浸入硫酸镁和硫酸铜的混合溶液中,过一会儿取出,观察到铝丝表面有固体析出,溶液里蓝色。此时溶液中含有 ____ 种溶质。【金属的冶炼】炼铁的主要原料是赤铁矿(主要成分是Fe2O3)焦炭、空气等,转化过程如图所示:?-|||-铁片-|||-K-|||-时 铜片(6)过程②中,发生反应的基本反应类型为 ____ 。(7)过程③中,1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量为 ____ (计算结果保留到整数)。【金属资源的利用和保护】(8)利用铁粉、炭粉、氯化钠进行铁的锈蚀实验。实验1min后温度计读数上升,8min后温度计恢复到原来温度。打开弹簧夹,水倒吸入锥形瓶中、实验装置及数据如下表:(装置气密性良好,使用氯化钠溶液的目的是加快铁的锈蚀) 实验装置 实验前的体积 实验后的体积 ?-|||-铁片-|||-K-|||-时 铜片 锥形瓶内空气(含导管内空气) 烧杯内水 烧杯内剩余水 246.0mL 100.0mL 51.5mL 下列说法不合理的是 ____ 填字母序号)。A.铁锈蚀过程中会放出热量B.计算得出空气中氧气的含量约为19.7%C.打开止水夹后,导管中残留水不会影响计算结果D.若未恢复到原来温度就打开弹簧夹,烧杯内剩余水大于51.5mL(9)如图是铁制品循环利用的示意图,一定发生化学变化的过程是 ____ (填序号)。废旧的铁锅、铁管属于 ____ (填“厨余垃圾”“可回收物”“有害垃圾”或“其他垃圾”)。废旧金属“循环利用”的意义是 ____ 。?-|||-铁片-|||-K-|||-时 铜片
对于金属材料,我们应从多角度了解。
【金属材料】
2023年5月,我国自主研制的C919大型客机成功完成首次商业载客飞行。国产大飞机翱翔蓝天,承载着国家意志、民族梦想和人民期盼。
(1)C919的机身采用了第三代铝锂合金,铝锂合金属于 ____ (填“金属材料”或“合成材料”)。
(2)飞机起落架是我国自主研发生产的合金钢。用合金钢制造起落架主要是利用其 ____ (写出一点即可)和耐腐蚀等性能。
【金属的性质】
(3)在常温下,铝制品耐腐蚀的原因为 ____ 。
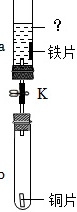
(4)如图所示实验,先向a中加入过量 ____ 充分反应后打开弹簧夹;使a中溶液个部进入b中,铜片表面没有变化,由此可证明铁、铜的金属活动性顺序以及与氢的位置关系为Fe>H>Cu。
(5)将铝丝浸入硫酸镁和硫酸铜的混合溶液中,过一会儿取出,观察到铝丝表面有固体析出,溶液里蓝色。此时溶液中含有 ____ 种溶质。
【金属的冶炼】
炼铁的主要原料是赤铁矿(主要成分是Fe2O3)焦炭、空气等,转化过程如图所示:

(6)过程②中,发生反应的基本反应类型为 ____ 。
(7)过程③中,1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量为 ____ (计算结果保留到整数)。
【金属资源的利用和保护】
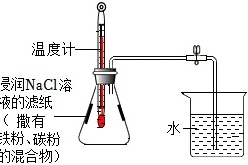
(8)利用铁粉、炭粉、氯化钠进行铁的锈蚀实验。实验1min后温度计读数上升,8min后温度计恢复到原来温度。打开弹簧夹,水倒吸入锥形瓶中、实验装置及数据如下表:(装置气密性良好,使用氯化钠溶液的目的是加快铁的锈蚀)
下列说法不合理的是 ____ 填字母序号)。
A.铁锈蚀过程中会放出热量
B.计算得出空气中氧气的含量约为19.7%
C.打开止水夹后,导管中残留水不会影响计算结果
D.若未恢复到原来温度就打开弹簧夹,烧杯内剩余水大于51.5mL
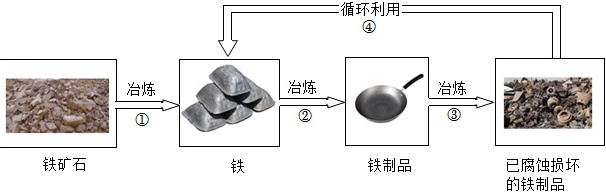
(9)如图是铁制品循环利用的示意图,一定发生化学变化的过程是 ____ (填序号)。废旧的铁锅、铁管属于 ____ (填“厨余垃圾”“可回收物”“有害垃圾”或“其他垃圾”)。废旧金属“循环利用”的意义是 ____ 。
【金属材料】
2023年5月,我国自主研制的C919大型客机成功完成首次商业载客飞行。国产大飞机翱翔蓝天,承载着国家意志、民族梦想和人民期盼。
(1)C919的机身采用了第三代铝锂合金,铝锂合金属于 ____ (填“金属材料”或“合成材料”)。
(2)飞机起落架是我国自主研发生产的合金钢。用合金钢制造起落架主要是利用其 ____ (写出一点即可)和耐腐蚀等性能。
【金属的性质】
(3)在常温下,铝制品耐腐蚀的原因为 ____ 。
(4)如图所示实验,先向a中加入过量 ____ 充分反应后打开弹簧夹;使a中溶液个部进入b中,铜片表面没有变化,由此可证明铁、铜的金属活动性顺序以及与氢的位置关系为Fe>H>Cu。

(5)将铝丝浸入硫酸镁和硫酸铜的混合溶液中,过一会儿取出,观察到铝丝表面有固体析出,溶液里蓝色。此时溶液中含有 ____ 种溶质。
【金属的冶炼】
炼铁的主要原料是赤铁矿(主要成分是Fe2O3)焦炭、空气等,转化过程如图所示:

(6)过程②中,发生反应的基本反应类型为 ____ 。
(7)过程③中,1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量为 ____ (计算结果保留到整数)。
【金属资源的利用和保护】
(8)利用铁粉、炭粉、氯化钠进行铁的锈蚀实验。实验1min后温度计读数上升,8min后温度计恢复到原来温度。打开弹簧夹,水倒吸入锥形瓶中、实验装置及数据如下表:(装置气密性良好,使用氯化钠溶液的目的是加快铁的锈蚀)
| 实验装置 | 实验前的体积 | 实验后的体积 | |
 |
锥形瓶内空气(含导管内空气) | 烧杯内水 | 烧杯内剩余水 |
| 246.0mL | 100.0mL | 51.5mL | |
A.铁锈蚀过程中会放出热量
B.计算得出空气中氧气的含量约为19.7%
C.打开止水夹后,导管中残留水不会影响计算结果
D.若未恢复到原来温度就打开弹簧夹,烧杯内剩余水大于51.5mL
(9)如图是铁制品循环利用的示意图,一定发生化学变化的过程是 ____ (填序号)。废旧的铁锅、铁管属于 ____ (填“厨余垃圾”“可回收物”“有害垃圾”或“其他垃圾”)。废旧金属“循环利用”的意义是 ____ 。

题目解答
答案
解:(1)铝锂合金属于金属材料;
(2)用合金钢制造起落架主要是利用其硬度大、强度高和耐腐蚀等性能;
(3)铝制品耐腐蚀是因为铝的化学性质比较活泼,在常温下能与空气中的氧气反应生成一层致密而坚硬的氧化铝薄膜,从而阻止了铝和氧气的进一步反应,对铝起到了保护作用;
(4)先向a中加入过量稀盐酸或稀硫酸,产生气泡,说明铁的金属活动性排在氢前面;充分反应后打开弹簧夹,使 a中溶液全部进入b中,铜片表面没有变化,说明铜的金属活动性排在氢后面,由此可证明铁、铜的金属活动性顺序以及与氢的位置关系为Fe>H>Cu;
(5)由金属活动性顺序可知镁>铝>铜,因此铝无法置换出硫酸镁中的镁,铝能置换出硫酸铜中的铜;溶液呈蓝色说明硫酸铜没有完全反应,即有剩余,故溶液中的溶质有硫酸镁、硫酸铝、硫酸铜三种;
(6)过程②中为二氧化碳与焦炭在高温条件下反应生成一氧化碳,化学方程式为$C{O}_{2}+C\frac{\underline{高温}}{\;}2CO$,符合“多变一”,因此属于化合反应;
(7)设1000t含氧化铁 80%的赤铁矿石可以炼出纯铁的质量为x。
1000t含氧化铁 80%的赤铁矿石中氧化铁的质量为1000t×80%=800t。
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
800t x
$\frac{160}{112}=\frac{800t}{x}$
x=560t
故可以炼出含铁 96%的生铁的质量为$\frac{560t}{96%}≈583t$;
(8)A、实验1min后温度计读数上升,说明铁锈蚀过程中会放出热量,不符合题意;
B、铁的锈蚀消耗锥形瓶中的氧气,反应结束后打开弹簧夹,水倒吸入锥形瓶中,吸入锥形瓶中水的体积则为氧气的体积,因此可以计算得出空气中氧气的含量约为(100mL-51.5mL)÷246mL≈19.7%,不符合题意;
C、打开止水夹后,导管中残留水会导致吸入锥形瓶中水的体积偏小,因此会影响计算结果,符合题意;
D、若未恢复到原来温度就打开弹簧夹,瓶内气压偏大,使得吸入锥形瓶中水的体积偏小,故烧杯内剩余水大于 51.5mL,不符合题意。
故选:C;
(9)铁矿石的冶炼和废旧金属的回收利用过程中有新物质生成,发生的变化属于化学变化,因此铁制品循环利用的示意图中,一定发生化学变化的过程有①④;废旧的铁锅、铁管属于可回收物;废旧金属“循环利用”的意义是节约金属资源,有利于保护环境等。
故答案为:(1)金属材料;
(2)硬度大(强度高,合理即可);
(3)铝的表面有一层致密的氧化铝薄膜;
(4)稀盐酸;
(5)3;
(6)化合反应;
(7)583t;
(8)C;
(9)①④;可回收物;节约金属资源(合理即可)。
(2)用合金钢制造起落架主要是利用其硬度大、强度高和耐腐蚀等性能;
(3)铝制品耐腐蚀是因为铝的化学性质比较活泼,在常温下能与空气中的氧气反应生成一层致密而坚硬的氧化铝薄膜,从而阻止了铝和氧气的进一步反应,对铝起到了保护作用;
(4)先向a中加入过量稀盐酸或稀硫酸,产生气泡,说明铁的金属活动性排在氢前面;充分反应后打开弹簧夹,使 a中溶液全部进入b中,铜片表面没有变化,说明铜的金属活动性排在氢后面,由此可证明铁、铜的金属活动性顺序以及与氢的位置关系为Fe>H>Cu;
(5)由金属活动性顺序可知镁>铝>铜,因此铝无法置换出硫酸镁中的镁,铝能置换出硫酸铜中的铜;溶液呈蓝色说明硫酸铜没有完全反应,即有剩余,故溶液中的溶质有硫酸镁、硫酸铝、硫酸铜三种;
(6)过程②中为二氧化碳与焦炭在高温条件下反应生成一氧化碳,化学方程式为$C{O}_{2}+C\frac{\underline{高温}}{\;}2CO$,符合“多变一”,因此属于化合反应;
(7)设1000t含氧化铁 80%的赤铁矿石可以炼出纯铁的质量为x。
1000t含氧化铁 80%的赤铁矿石中氧化铁的质量为1000t×80%=800t。
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
800t x
$\frac{160}{112}=\frac{800t}{x}$
x=560t
故可以炼出含铁 96%的生铁的质量为$\frac{560t}{96%}≈583t$;
(8)A、实验1min后温度计读数上升,说明铁锈蚀过程中会放出热量,不符合题意;
B、铁的锈蚀消耗锥形瓶中的氧气,反应结束后打开弹簧夹,水倒吸入锥形瓶中,吸入锥形瓶中水的体积则为氧气的体积,因此可以计算得出空气中氧气的含量约为(100mL-51.5mL)÷246mL≈19.7%,不符合题意;
C、打开止水夹后,导管中残留水会导致吸入锥形瓶中水的体积偏小,因此会影响计算结果,符合题意;
D、若未恢复到原来温度就打开弹簧夹,瓶内气压偏大,使得吸入锥形瓶中水的体积偏小,故烧杯内剩余水大于 51.5mL,不符合题意。
故选:C;
(9)铁矿石的冶炼和废旧金属的回收利用过程中有新物质生成,发生的变化属于化学变化,因此铁制品循环利用的示意图中,一定发生化学变化的过程有①④;废旧的铁锅、铁管属于可回收物;废旧金属“循环利用”的意义是节约金属资源,有利于保护环境等。
故答案为:(1)金属材料;
(2)硬度大(强度高,合理即可);
(3)铝的表面有一层致密的氧化铝薄膜;
(4)稀盐酸;
(5)3;
(6)化合反应;
(7)583t;
(8)C;
(9)①④;可回收物;节约金属资源(合理即可)。