[H]=H2(g)G = - 72,950.60.90T, J·mol-1lgK=+3.181.0.C时, H2的平衡压力=1.64105w[H]×0.1013MPa (2-2-134)一个氩气泡上浮过程脱氢的量为 , mol一个气泡上浮引起钢液中氢含量的下降为dw[H]%,,dn与dw[H]%的关系为 (2-2-135)式中w钢液量,t;M[H] 氢原子的摩尔质量, kg·mol-1;dV氩气在标态下的体积, m3。整理并代入式(2-2-134)得上式积分后得 (2-2-136)式中w[H] 开始吹氩时钢液中氢的质量百分数;w[H] 吹氩结束时钢液中氢的质量百分数。还可以应用类似的方法推导出吹氩(或氮)过程脱碳反应速率和脱氢速率的关系 (2-2-137)对吹氩去氮也可以导出与式(2-2-136)、(2-2-137)相应的公式。但是气泡中氮分压远不能达平衡。生产实践证明, 吹氩没有明显的脱氮效果。原因可能是脱氮过程动力学规律较复杂。氮的扩散不是唯一的控速环节, 界面化学反应也有较大的阻力。例题2-2-3已知钢液原始氢含量为810-4%, 求在1600C将氢含量降至410-4%.每吨钢水所需的吹氩量。解 将式(2-2-136)两边除以钢包中钢水量w, 得代入w[H]及w[H]值,得m3·t-1解得所需的氩气量为每吨钢0.854 m3(标态)。例题2-2-4若在钢包吹氩过程中碳含量可视为常数,为0.5%,不平衡常数=0.5,计算将钢液中氧含量由0.004%降至0.001%每吨钢水所需的吹氩量。解 由式(2-2-132)可得单位体积钢液所需的吹氩量代入w[C]%、w[O]、w[O]值 =0.155(m3·t-1)解得所需的氩气量为每吨钢0.155 m3(标态)。真空冶金过程动力学讨论真空技术在冶金生产中的应用大体上可以划分为两大类。一类用于钢水的处理,最常应用的有真空铸锭、钢包真空处理、RH和DH真空精炼等,通常称为真空处理;另一类属于真空熔炼过程,如真空自耗熔炼,真空电渣熔炼。在真空条件下,有良好的去除金属液中溶解的氢、氧等有害杂质的有利条件,提高冶金产品的质量。但是,真空也加速了合金元素的挥发.掌握真空冶金过程动力学有利于控制这些过程。以下介绍真空去气的基本动力学规律。金属液去气过程的组成步骤为:1)溶解于金属液中的气体原子通过对流和扩散迁移到金属液面或气泡表面;2)在金属液或气泡表面上发生界面化学反应, 生成气体分子。这一步骤又包括反应物的吸附,化学反应本身及气体生成物的脱附;3)气体分子通过气体边界层扩散进入气相, 或被气泡带入气相,并被真空泵抽出。根据大多数研究结果,钢液中吸氢、脱氢、脱氧过程由钢液边界层中的传质控制,传质速率 (2-2-138)式中A表面积;cm钢液内部浓度;c气液界面处的浓度。由物质平衡可得 (2-2-139)式中 V钢液的体积。该式说明传质速率等于去气(氢或氧)的速率。联立式 (2-2-138) 和 (2-2-139) 可得 (2-2-140)假设表面浓度为常数,积分上式得 (2-2-141)式中c、cm钢液的原始浓度及真空处理t时该元素的浓度。上式中的浓度可以用mol·m-3为单位, 也可以用质量分数。该式说明, 如果脱气过程为传质步骤控制, 则表现为一级反应规律,如脱氢和脱氧过程属于这一种机理。2.3液/液反应动力学液/液反应是指两个不相溶的液相之间的反应。这类反应对冶金过程十分重要。例如,电炉炼钢过程,从炉内形成钢液熔体开始,直至出钢为止,液/液反应贯穿于整个熔化、氧化和还原过程中。例如,熔化期和氧化期中钢液中C、Si、Mn、P及某些合金元素的氧化,就包含有渣中氧化铁和钢中这些元素之间的反应。还原期的脱硫也是渣钢之间的反应。有色冶金也有类似的情况。如湿法提取冶金中用萃取的方法进行分离和提纯就是典型的液/液反应的例子。在火法冶金过程中,鼓风炉炼制粗铅及转炉吹炼粗铜都包含有熔渣和金属熔体之间的液/液反应。液/液反应机理的共同特点在于,反应物来自两个不同的液相,然后在共同的相界面上发生界面化学反应,最后生成物再以扩散的方式从相界面传递到不同的液相中。寻求这样的反应的规律,较多地应用了双膜理论。液/液反应的限制性环节一般分为两类。一类以扩散为限制性环节;另一类是以界面化学反应为限制性环节。对这两类不同的反应过程,温度、浓度、搅拌速度等外界条件对速度的影响也是不同的,借此可用来判断限制性环节。大量事实说明,在液/液反应中,尤其是高温冶金反应中,大部分限制性环节处于扩散范围,只有一小部分反应属于界面化学反应类型。尽管后者代表的反应不多,但其机理研究却很重要,一般说来,处理的难度也较前者大。2.3.1金属液-熔渣反应机理一般是应用双膜理论分析金属液/熔渣反应机理和反应速率。金属液/熔渣反应主要以以下两种反应进行。[A] + (B z+ ) = (Az+ ) + [B] (2-2-142)[A] + ( B z- ) = ( Az- ) + [B] (2-2-143)式中, [A]、[B] 金属液中以原子状态存在的组元A、B;(Az+ )、 (Az- )、 ( Bz+ )、 ( Bz- ) 熔渣中以正(负)离子状态存在的组元A、B。就反应机理,整个反应包括如下步骤:1)组元 [A] 由金属液内穿过金属液一侧边界层向金属液/熔渣界面迁移;2)组元(Bz+)由渣相内穿过渣相一侧边界层向熔渣/金属液界面的迁移;3)在界面上发生化学反应 4)反应产物 (Az+)*由熔渣/金属液界面穿过渣相边界层向渣相内迁移;5)反应产物 [B]* 由金属液/熔渣界面穿过金属液边界层向金属液内部迁移。图2-2-12是组元A在熔渣、金属液两相中浓度分布示意图。图中S 与M -----分别为渣相及金属液边界层的厚度;、c[A]-----分别为其在渣相及金属液中的浓度;----为组元A在渣膜一侧界面处的浓度;----为组元A在金属液膜一侧界面处的浓度。需改动图2-2-12组元A在熔渣与金属液中浓度分布示意图对于一般情况,若组元A在钢液和在渣中的扩散及在界面化学反应速率差不多,每一步的物质流密度如下:在金属液边界层的物质流密度 (2-2-144)在渣相边界层的物质流密度 (2-2-145)若界面化学反应为一级反应时,则正反应速率为 (2-2-146)逆反应速率为 (2-2-147)式中k、 k正、逆反应的速率常数;v、v正、逆反应速率。当正、逆反应速率相等,达到动态平衡时,则 (2-2-148)当正、逆反应速率不相等时,则化学反应净速率为总反应过程可以认为是稳态,则 (2-2-149)或 采用合分比的方法可以得出 (2-2-150)这里,分别表示A在钢液、渣中的传质和在界面上化学反应的阻力。这就是双膜理论在渣钢反应应用的数学模型。可以看出,总反应速率与两相间的浓度差成正比,与总反应的阻力成反比。讨论:1)若A在钢液中的传质是限制环节,即则在渣中的阻力和化学反应的阻力可以忽略,此时,总过程的速率由 所以 2)若A在渣中的传质是限制环节,则在钢液中的阻力和化学反应的阻力可以忽略,此时,总过程的速率由 所以 3)若A在渣钢界面化学反应是限制环节,则在钢液和渣中的阻力可以忽略,此时,总过程的速率在炼钢的高温情况下,一般说来,化学反应速率是很快的,不是过程的限制性环节。总的速率多决定于组元的传质速率。2.3.2钢中锰氧化的动力学钢中锰的氧化从熔化期就开始了。在电炉炼钢过程中,Mn的氧化主要是通过与渣中FeO的相互作用而发生的,这是一个典型的钢渣反应。 [Mn]+(FeO)=(MnO)+[Fe] (2-2-151)我们可以利用双膜理论计算该反应的速率,讨论反应过程的机理。例2-2-5: 27.电炉炼钢过程中,求正常沸腾的条件下Mn的氧化速率。设炉温为160.℃,渣的成分为: w(FeO)=20%; w(MnO)=5%, 而钢中Mn含量为0.2%,钢的密度=7.010kg·m,渣的密度=3.510kg·m。渣钢界面积为15m, Mn、Mn、Fe、Fe的扩散系数D以及它们在钢渣界面扩散时边界层厚度 已由实验求得,如表2-2-2所示。
0.60.90T, J·mol-1lgK=+
3.18
1.
0.C时, H2的平衡压力=1.64105w[H]×0.1013MPa (2-2-134)一个氩气泡上浮过程脱氢的量为 , mol一个气泡上浮引起钢液中氢含量的下降为dw[H]%,,dn与dw[H]%的关系为 (2-2-135)式中w钢液量,t;M[H] 氢原子的摩尔质量, kg·mol-1;dV氩气在标态下的体积, m3。整理并代入式(2-2-134)得上式积分后得 (2-2-136)式中w[H] 开始吹氩时钢液中氢的质量百分数;w[H] 吹氩结束时钢液中氢的质量百分数。还可以应用类似的方法推导出吹氩(或氮)过程脱碳反应速率和脱氢速率的关系 (2-2-137)对吹氩去氮也可以导出与式(2-2-136)、(2-2-137)相应的公式。但是气泡中氮分压远不能达平衡。生产实践证明, 吹氩没有明显的脱氮效果。原因可能是脱氮过程动力学规律较复杂。氮的扩散不是唯一的控速环节, 界面化学反应也有较大的阻力。例题2-2-3已知钢液原始氢含量为810-4%, 求在1600C将氢含量降至410-4%.每吨钢水所需的吹氩量。解 将式(2-2-136)两边除以钢包中钢水量w, 得代入w[H]及w[H]值,得m3·t-1解得所需的氩气量为每吨钢
0.854 m3(标态)。例题2-2-4若在钢包吹氩过程中碳含量可视为常数,为
0.5%,不平衡常数=0.5,计算将钢液中氧含量由0.004%降至0.001%每吨钢水所需的吹氩量。解 由式(2-2-132)可得单位体积钢液所需的吹氩量代入w[C]%、w[O]、w[O]值 =
0.155(m3·t-1)解得所需的氩气量为每吨钢
0.155 m3(标态)。真空冶金过程动力学讨论真空技术在冶金生产中的应用大体上可以划分为两大类。一类用于钢水的处理,最常应用的有真空铸锭、钢包真空处理、RH和DH真空精炼等,通常称为真空处理;另一类属于真空熔炼过程,如真空自耗熔炼,真空电渣熔炼。在真空条件下,有良好的去除金属液中溶解的氢、氧等有害杂质的有利条件,提高冶金产品的质量。但是,真空也加速了合金元素的挥发.掌握真空冶金过程动力学有利于控制这些过程。以下介绍真空去气的基本动力学规律。金属液去气过程的组成步骤为:1)溶解于金属液中的气体原子通过对流和扩散迁移到金属液面或气泡表面;2)在金属液或气泡表面上发生界面化学反应, 生成气体分子。这一步骤又包括反应物的吸附,化学反应本身及气体生成物的脱附;3)气体分子通过气体边界层扩散进入气相, 或被气泡带入气相,并被真空泵抽出。根据大多数研究结果,钢液中吸氢、脱氢、脱氧过程由钢液边界层中的传质控制,传质速率 (2-2-138)式中A表面积;cm钢液内部浓度;c气液界面处的浓度。由物质平衡可得 (2-2-139)式中 V钢液的体积。该式说明传质速率等于去气(氢或氧)的速率。联立式 (2-2-138) 和 (2-2-139) 可得 (2-2-140)假设表面浓度为常数,积分上式得 (2-2-141)式中c、cm钢液的原始浓度及真空处理t时该元素的浓度。上式中的浓度可以用mol·m-3为单位, 也可以用质量分数。该式说明, 如果脱气过程为传质步骤控制, 则表现为一级反应规律,如脱氢和脱氧过程属于这一种机理。
2.3液/液反应动力学液/液反应是指两个不相溶的液相之间的反应。这类反应对冶金过程十分重要。例如,电炉炼钢过程,从炉内形成钢液熔体开始,直至出钢为止,液/液反应贯穿于整个熔化、氧化和还原过程中。例如,熔化期和氧化期中钢液中C、Si、Mn、P及某些合金元素的氧化,就包含有渣中氧化铁和钢中这些元素之间的反应。还原期的脱硫也是渣钢之间的反应。有色冶金也有类似的情况。如湿法提取冶金中用萃取的方法进行分离和提纯就是典型的液/液反应的例子。在火法冶金过程中,鼓风炉炼制粗铅及转炉吹炼粗铜都包含有熔渣和金属熔体之间的液/液反应。液/液反应机理的共同特点在于,反应物来自两个不同的液相,然后在共同的相界面上发生界面化学反应,最后生成物再以扩散的方式从相界面传递到不同的液相中。寻求这样的反应的规律,较多地应用了双膜理论。液/液反应的限制性环节一般分为两类。一类以扩散为限制性环节;另一类是以界面化学反应为限制性环节。对这两类不同的反应过程,温度、浓度、搅拌速度等外界条件对速度的影响也是不同的,借此可用来判断限制性环节。大量事实说明,在液/液反应中,尤其是高温冶金反应中,大部分限制性环节处于扩散范围,只有一小部分反应属于界面化学反应类型。尽管后者代表的反应不多,但其机理研究却很重要,一般说来,处理的难度也较前者大。
2.
3.1金属液-熔渣反应机理一般是应用双膜理论分析金属液/熔渣反应机理和反应速率。金属液/熔渣反应主要以以下两种反应进行。[A] + (B z+ ) = (Az+ ) + [B] (2-2-142)[A] + ( B z- ) = ( Az- ) + [B] (2-2-143)式中, [A]、[B] 金属液中以原子状态存在的组元A、B;(Az+ )、 (Az- )、 ( Bz+ )、 ( Bz- ) 熔渣中以正(负)离子状态存在的组元A、B。就反应机理,整个反应包括如下步骤:1)组元 [A] 由金属液内穿过金属液一侧边界层向金属液/熔渣界面迁移;2)组元(Bz+)由渣相内穿过渣相一侧边界层向熔渣/金属液界面的迁移;3)在界面上发生化学反应 4)反应产物 (Az+)*由熔渣/金属液界面穿过渣相边界层向渣相内迁移;5)反应产物 [B]* 由金属液/熔渣界面穿过金属液边界层向金属液内部迁移。图2-2-12是组元A在熔渣、金属液两相中浓度分布示意图。图中S 与M -----分别为渣相及金属液边界层的厚度;、c[A]-----分别为其在渣相及金属液中的浓度;----为组元A在渣膜一侧界面处的浓度;----为组元A在金属液膜一侧界面处的浓度。需改动图2-2-12组元A在熔渣与金属液中浓度分布示意图对于一般情况,若组元A在钢液和在渣中的扩散及在界面化学反应速率差不多,每一步的物质流密度如下:在金属液边界层的物质流密度 (2-2-144)在渣相边界层的物质流密度 (2-2-145)若界面化学反应为一级反应时,则正反应速率为 (2-2-146)逆反应速率为 (2-2-147)式中k、 k正、逆反应的速率常数;v、v正、逆反应速率。当正、逆反应速率相等,达到动态平衡时,则 (2-2-148)当正、逆反应速率不相等时,则化学反应净速率为总反应过程可以认为是稳态,则 (2-2-149)或 采用合分比的方法可以得出 (2-2-150)这里,分别表示A在钢液、渣中的传质和在界面上化学反应的阻力。这就是双膜理论在渣钢反应应用的数学模型。可以看出,总反应速率与两相间的浓度差成正比,与总反应的阻力成反比。讨论:1)若A在钢液中的传质是限制环节,即则在渣中的阻力和化学反应的阻力可以忽略,此时,总过程的速率由 所以 2)若A在渣中的传质是限制环节,则在钢液中的阻力和化学反应的阻力可以忽略,此时,总过程的速率由 所以 3)若A在渣钢界面化学反应是限制环节,则在钢液和渣中的阻力可以忽略,此时,总过程的速率在炼钢的高温情况下,一般说来,化学反应速率是很快的,不是过程的限制性环节。总的速率多决定于组元的传质速率。
2.
3.2钢中锰氧化的动力学钢中锰的氧化从熔化期就开始了。在电炉炼钢过程中,Mn的氧化主要是通过与渣中FeO的相互作用而发生的,这是一个典型的钢渣反应。 [Mn]+(FeO)=(MnO)+[Fe] (2-2-151)我们可以利用双膜理论计算该反应的速率,讨论反应过程的机理。例2-2-5: 2
7.电炉炼钢过程中,求正常沸腾的条件下Mn的氧化速率。设炉温为16
0.℃,渣的成分为: w(FeO)=20%; w(MnO)=5%, 而钢中Mn含量为0.2%,钢的密度=7.010kg·m,渣的密度=
3.510kg·m。渣钢界面积为15m, Mn、Mn、Fe、Fe的扩散系数D以及它们在钢渣界面扩散时边界层厚度 已由实验求得,如表2-2-2所示。
题目解答
答案
结果表明第5步进行得很快,不可能成为限制性环节。第1、2、4步的最大速率虽然不一样,但差别不很大,并不存在一个速率特别慢的环节,因而整个反应速度不能用其中任何一环节的最大速率代替。一般说来,实际速率要比以上列举的诸数值小。
讨论:
以上分析是在给定条件下的结果,条件发生变化,情况也随之有所改变。
1)刚开始反应时,渣中不存在MnO(c= 0),Q=0,在此条件下,各环节的最大速率将发生变化。根据式(2-2-160)(2-2-163),第4步将大为加速,第1、2步速率虽有增加但不明显。最慢的步骤将落在第1、2步上,尤其是第2步,即Fe的传递将是主要障碍。
2)如果是通过吹氧或加矿(氧化铁)来进行氧化时,Fe的迁移将大大加速。在此情况下,第1步是限制性环节,Mn的氧化速率可近似地以第一步的速率来考虑。以第1步来计算时,去除Mn的速率为
式中 与渣中Mn成平衡的钢中锰浓度。进一步假设,渣成分与最终平衡成分差别也不大,因而 的变化不大,可近似地以整个炉子达到平衡时Mn成分c来表示。于是上式 成为
(2-2-165)
因为
而 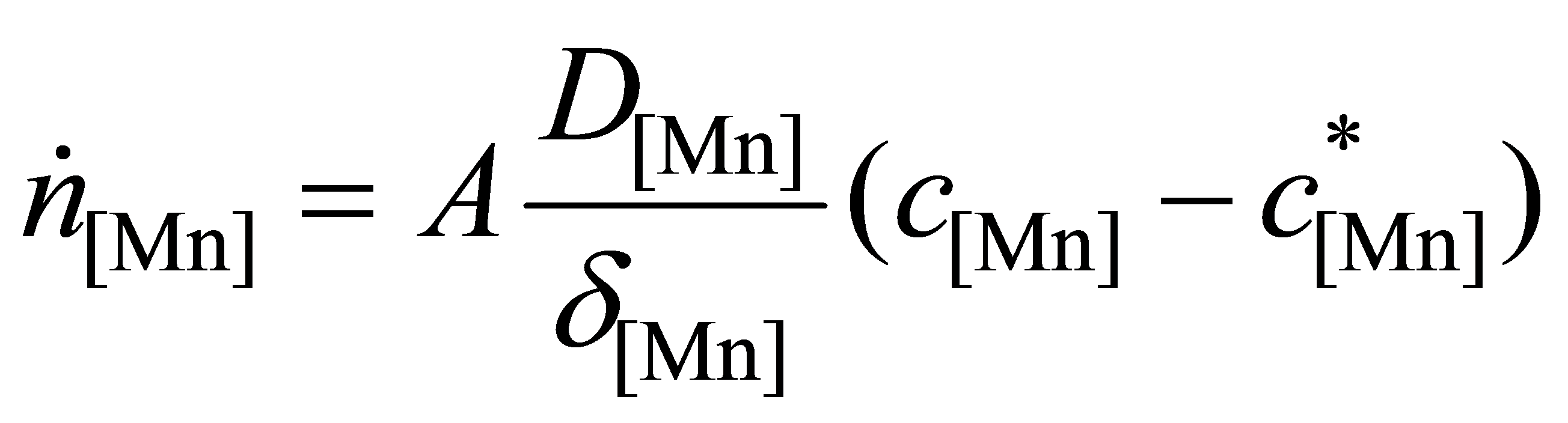
所以 
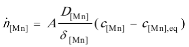
式中,V为钢液的体积。以上各式代入式(2-2-165)得
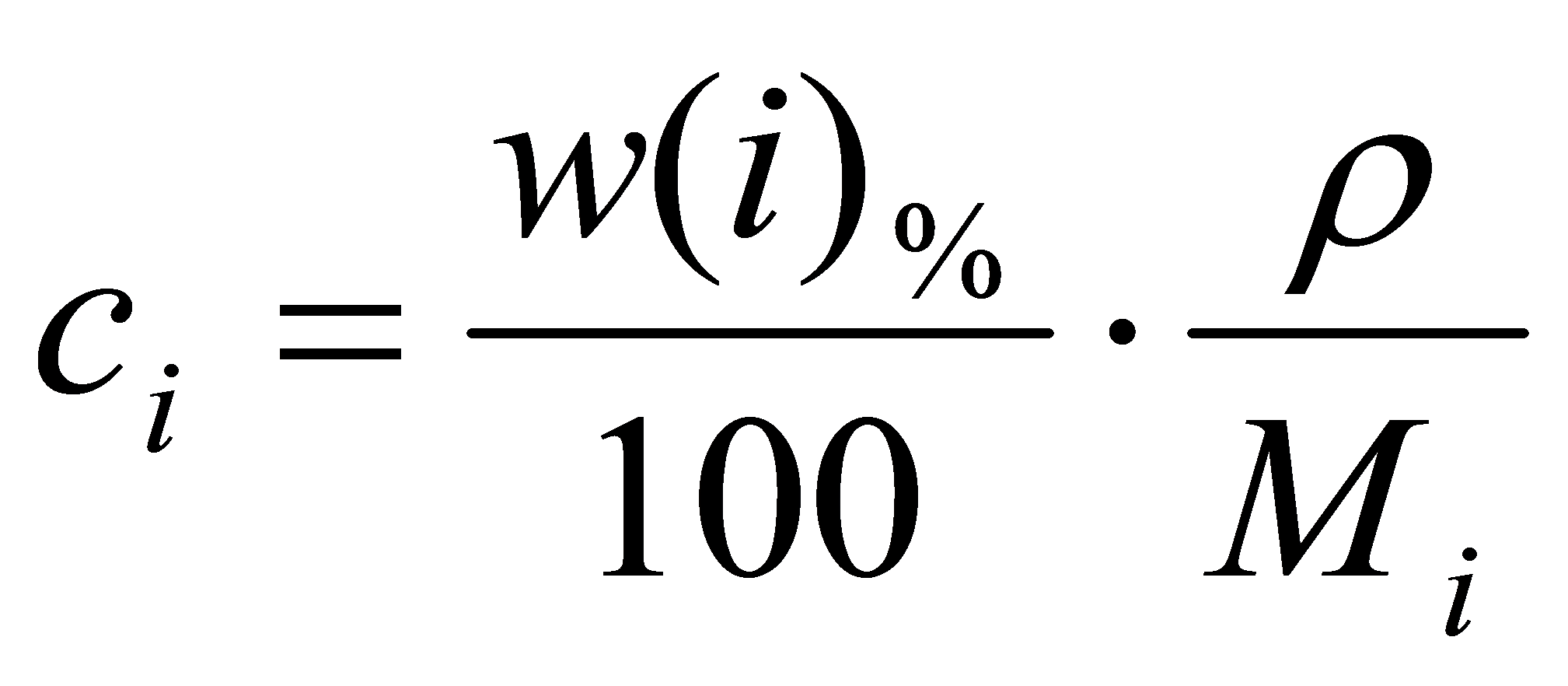
假设t=0时,Mn的浓度为w[Mn],反应进行到t时, Mn的浓度为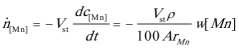 ,积分上式得到
,积分上式得到
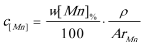 (2-2-166)
(2-2-166)
可以计算Mn被去除掉90%时所需要的时间(忽略w[Mn]),即
式中钢液体积V=2710/7000 m=3.87m,其余各系数表2-2-2中已给出,由此算出所需的时间t为
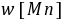 =1790(s)=29.8(min)
=1790(s)=29.8(min)
在上述条件下,在27t电炉炼钢去Mn的时间约为30min左右,这一计算结果与实际情况很接近。
2.4钢铁冶金热力学与动力学应用实例
2.4.1奥氏体不锈钢冶炼过程热力学分析
奥氏体不锈钢冶炼的三个阶段
所谓“不锈”是指抗晶间腐蚀能强,况且钢中含碳量越低,则抗腐蚀能力越强。
是奥氏体不锈钢的典型钢种,其成分标准:,,,,,。
不锈钢的发展方向是超低碳不锈钢,即或更低。为此,自发现不锈钢至今,共经历了三个发展阶段: