题目
4.6 在18℃,氧气和氮气压力均为101.352kPa时,1dm^3的水中能溶解O2 0.045 g、N2-|||-0.02g。现将1dm^3被202.65 kPa空气所饱和了的水溶液加热至沸腾,赶出所溶解的O2和-|||-N2,并干燥之,求此干燥气体在101.325kPa、18 ℃下的体积及其组成。设空气为理想气体混-|||-合物,其组成的体积分数为: (varphi )_({O)_(2)}=0.21, varphi (x)_(2)=0.79

题目解答
答案
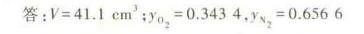
解析
步骤 1:计算溶解在1 dm^3水中的氧气和氮气的质量
根据题目,1 dm^3的水中能溶解O2 0.045g、N2 0.02g。因此,溶解在1 dm^3水中的氧气和氮气的质量分别为0.045g和0.02g。
步骤 2:计算溶解在1 dm^3水中的氧气和氮气的摩尔数
氧气的摩尔质量为32 g/mol,氮气的摩尔质量为28 g/mol。因此,溶解在1 dm^3水中的氧气和氮气的摩尔数分别为:
${n}_{{O}_{2}}=\frac{0.045}{32}=0.00140625$ mol
${n}_{{N}_{2}}=\frac{0.02}{28}=0.000714286$ mol
步骤 3:计算干燥气体的总体积
根据理想气体状态方程PV=nRT,其中P为压力,V为体积,n为摩尔数,R为理想气体常数,T为温度。将干燥气体的总体积设为V,压力为101.325 kPa,温度为18℃(291.15 K),理想气体常数R为8.314 J/(mol·K)。则有:
$V=\frac{nRT}{P}=\frac{(0.00140625+0.000714286)\times 8.314\times 291.15}{101325}=41.1\times {10}^{-6}{m}^{3}=41.1{cm}^{3}$
步骤 4:计算干燥气体中氧气和氮气的摩尔分数
干燥气体中氧气和氮气的摩尔分数分别为:
${y}_{{O}_{2}}=\frac{{n}_{{O}_{2}}}{{n}_{{O}_{2}}+{n}_{{N}_{2}}}=\frac{0.00140625}{0.00140625+0.000714286}=0.3434$
${y}_{{N}_{2}}=\frac{{n}_{{N}_{2}}}{{n}_{{O}_{2}}+{n}_{{N}_{2}}}=\frac{0.000714286}{0.00140625+0.000714286}=0.6566$
根据题目,1 dm^3的水中能溶解O2 0.045g、N2 0.02g。因此,溶解在1 dm^3水中的氧气和氮气的质量分别为0.045g和0.02g。
步骤 2:计算溶解在1 dm^3水中的氧气和氮气的摩尔数
氧气的摩尔质量为32 g/mol,氮气的摩尔质量为28 g/mol。因此,溶解在1 dm^3水中的氧气和氮气的摩尔数分别为:
${n}_{{O}_{2}}=\frac{0.045}{32}=0.00140625$ mol
${n}_{{N}_{2}}=\frac{0.02}{28}=0.000714286$ mol
步骤 3:计算干燥气体的总体积
根据理想气体状态方程PV=nRT,其中P为压力,V为体积,n为摩尔数,R为理想气体常数,T为温度。将干燥气体的总体积设为V,压力为101.325 kPa,温度为18℃(291.15 K),理想气体常数R为8.314 J/(mol·K)。则有:
$V=\frac{nRT}{P}=\frac{(0.00140625+0.000714286)\times 8.314\times 291.15}{101325}=41.1\times {10}^{-6}{m}^{3}=41.1{cm}^{3}$
步骤 4:计算干燥气体中氧气和氮气的摩尔分数
干燥气体中氧气和氮气的摩尔分数分别为:
${y}_{{O}_{2}}=\frac{{n}_{{O}_{2}}}{{n}_{{O}_{2}}+{n}_{{N}_{2}}}=\frac{0.00140625}{0.00140625+0.000714286}=0.3434$
${y}_{{N}_{2}}=\frac{{n}_{{N}_{2}}}{{n}_{{O}_{2}}+{n}_{{N}_{2}}}=\frac{0.000714286}{0.00140625+0.000714286}=0.6566$