题目
氯碱工业(1)概念:用电解______的方法来制取______,并以它们为原料生产一系列化工产品的工业,称为氯碱工业。(2)原理:①通电前,氯化钠溶液中含有的离子是______。通电时,移向阳极的离子是______,移向阴极的离子是______。②阳极反应式为2Cl--2e-===Cl2↑;阴极反应式为2H++2e-===H2↑;因______放电,促进了水的电离,使阴极区溶液显______性。③电解的总反应式化学方程式为2NaCl+2H2Oo(====,则电)H2↑+Cl2↑+2NaOH;离子方程式为2Cl-+2H2Oo(====,则电)H2↑+Cl2↑+2OH-。(3)氯碱工业生产流程①阳离子交换膜电解槽②阳离子交换膜的作用:只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可以防止阴极产生的氢气与阳极产生的氯气混合发生爆炸,也能避免氯气与阴极产生的氢氧化钠反应而影响氢氧化钠的产量和质量。相关链接(1)氯碱工业规律的记忆口诀:氢气烧碱出阴极,氯气阳极相隔离。①因为阳极产物Cl2和阴极产物H2会发生反应,Cl2和NaOH会发生反应,因此工业上常用特殊的电解槽电解饱和食盐水,一般用阳离子交换膜将电解槽分隔成两部分,以避免电解产物之间发生反应。②阳极区Cl-放电生成Cl2,生成的Cl2少量溶于水会使阳极区呈酸性。(2)离子交换膜法制烧碱离子交换膜法电解饱和食盐水制烧碱的主要原理是使用的阳离子交换膜有特殊的选择透过性,只允许阳离子通过而阻止阴离子和气体通过,即只允许H+、Na+通过,而Cl-、OH-和两极产物H2和Cl2无法通过,因而起到了防止阳极产物Cl2和阴极产物H2相混合而导致爆炸的危险,还起到了避免Cl2和阴极另一产物NaOH反应而影响烧碱纯度的作用,其装置如图所示。当接通电源后,在电场的作用下,带负电的Cl-和OH-移向阳极,带正电的Na+和H+移向阴极,在这种条件下,电极上发生的反应分别为阳极:2Cl--2e-===Cl2↑阴极:2H++2e-===H2↑随着电解的不断进行,阴极区溶液的OH-浓度越来越大,并生成NaOH,电解饱和食盐水的总反应为2NaCl+2H2Oo(====,则电)2NaOH+H2↑+Cl2↑。
氯碱工业
(1)概念:用电解______的方法来制取______,并以它们为原料生产一系列化工产品的工业,称为氯碱工业。
(2)原理:
①通电前,氯化钠溶液中含有的离子是______。
通电时,移向阳极的离子是______,移向阴极的离子是______。
②阳极反应式为2Cl--2e-===Cl2↑;
阴极反应式为2H++2e-===H2↑;
因______放电,促进了水的电离,使阴极区溶液显______性。
③电解的总反应式
化学方程式为2NaCl+2H2O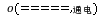 H2↑+Cl2↑+2NaOH;
H2↑+Cl2↑+2NaOH;
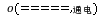 H2↑+Cl2↑+2NaOH;
H2↑+Cl2↑+2NaOH;离子方程式为2Cl-+2H2O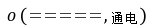 H2↑+Cl2↑+2OH-。
H2↑+Cl2↑+2OH-。
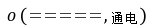 H2↑+Cl2↑+2OH-。
H2↑+Cl2↑+2OH-。(3)氯碱工业生产流程
①阳离子交换膜电解槽
②阳离子交换膜的作用:只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可以防止阴极产生的氢气与阳极产生的氯气混合发生爆炸,也能避免氯气与阴极产生的氢氧化钠反应而影响氢氧化钠的产量和质量。
相关链接
(1)氯碱工业规律的记忆口诀:
氢气烧碱出阴极,氯气阳极相隔离。
①因为阳极产物Cl2和阴极产物H2会发生反应,Cl2和NaOH会发生反应,因此工业上常用特殊的电解槽电解饱和食盐水,一般用阳离子交换膜将电解槽分隔成两部分,以避免电解产物之间发生反应。
②阳极区Cl-放电生成Cl2,生成的Cl2少量溶于水会使阳极区呈酸性。
(2)离子交换膜法制烧碱
离子交换膜法电解饱和食盐水制烧碱的主要原理是使用的阳离子交换膜有特殊的选择透过性,只允许阳离子通过而阻止阴离子和气体通过,即只允许H+、Na+通过,而Cl-、OH-和两极产物H2和Cl2无法通过,因而起到了防止阳极产物Cl2和阴极产物H2相混合而导致爆炸的危险,还起到了避免Cl2和阴极另一产物NaOH反应而影响烧碱纯度的作用,其装置如图所示。
当接通电源后,在电场的作用下,带负电的Cl-和OH-移向阳极,带正电的Na+和H+移向阴极,在这种条件下,电极上发生的反应分别为
阳极:2Cl--2e-===Cl2↑
阴极:2H++2e-===H2↑
随着电解的不断进行,阴极区溶液的OH-浓度越来越大,并生成NaOH,电解饱和食盐水的总反应为2NaCl+2H2O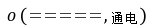 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
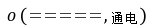 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。题目解答
答案
饱和食盐水 氢氧化钠、氢气和氯气 Na+、Cl-、H+、OH- Cl-、OH- Na+、H+ H+ 碱
解析
步骤 1:电解饱和食盐水的概念
用电解饱和食盐水的方法来制取氢氧化钠、氢气和氯气,并以它们为原料生产一系列化工产品的工业,称为氯碱工业。
步骤 2:电解前氯化钠溶液中的离子
通电前,氯化钠溶液中含有的离子是Na⁺、Cl⁻、H⁺、OH⁻。通电时,移向阳极的离子是Cl⁻、OH⁻,移向阴极的离子是Na⁺、H⁺。
步骤 3:电解过程中的反应
阳极反应式为2Cl⁻-2e⁻===Cl₂↑;阴极反应式为2H⁺+2e⁻===H₂↑;因H⁺放电,促进了水的电离,使阴极区溶液显碱性。
步骤 4:电解的总反应式
电解的总反应式化学方程式为2NaCl+2H₂O电解H₂↑+Cl₂↑+2NaOH;离子方程式为2Cl⁻+2H₂O电解H₂↑+Cl₂↑+2OH⁻。
步骤 5:阳离子交换膜的作用
阳离子交换膜的作用:只允许Na⁺等阳离子通过,不允许Cl⁻、OH⁻等阴离子及气体分子通过,可以防止阴极产生的氢气与阳极产生的氯气混合发生爆炸,也能避免氯气与阴极产生的氢氧化钠反应而影响氢氧化钠的产量和质量。
用电解饱和食盐水的方法来制取氢氧化钠、氢气和氯气,并以它们为原料生产一系列化工产品的工业,称为氯碱工业。
步骤 2:电解前氯化钠溶液中的离子
通电前,氯化钠溶液中含有的离子是Na⁺、Cl⁻、H⁺、OH⁻。通电时,移向阳极的离子是Cl⁻、OH⁻,移向阴极的离子是Na⁺、H⁺。
步骤 3:电解过程中的反应
阳极反应式为2Cl⁻-2e⁻===Cl₂↑;阴极反应式为2H⁺+2e⁻===H₂↑;因H⁺放电,促进了水的电离,使阴极区溶液显碱性。
步骤 4:电解的总反应式
电解的总反应式化学方程式为2NaCl+2H₂O电解H₂↑+Cl₂↑+2NaOH;离子方程式为2Cl⁻+2H₂O电解H₂↑+Cl₂↑+2OH⁻。
步骤 5:阳离子交换膜的作用
阳离子交换膜的作用:只允许Na⁺等阳离子通过,不允许Cl⁻、OH⁻等阴离子及气体分子通过,可以防止阴极产生的氢气与阳极产生的氯气混合发生爆炸,也能避免氯气与阴极产生的氢氧化钠反应而影响氢氧化钠的产量和质量。