题目
某化学兴趣小组做了如图所示实验,当向乙烧杯中依次加入MnO2和H2O2溶液时,发现有大量气泡产生,并产生大量白雾,蜡烛燃烧更旺,但过一会儿逐渐熄灭。而甲烧杯中蜡烛一直持续燃烧。MnO2-|||-A-|||-200mL-|||-H2O2溶液-|||-甲 乙 乙【知识回忆】写出过氧化氢分解产生氧气的化学方程式: ____ 。【问题1】导致乙烧杯中蜡烛熄灭的原因是什么?【作出猜想】猜想一:燃烧产生的CO2使蜡烛熄灭;猜想二:白雾是水雾导致蜡烛熄灭;小组同学经过讨论,排除了猜想一,其理由是 ____ 。【实验1】向一只装有燃者蜡烛的烧杯中加入100℃水,另一只依次加入MnO2和H2O2溶液,若观察到 ____ 的现象,则猜想二正确。【查阅资料】水雾产生与H2O2溶液的溶质质量分数大小有关,并且H2O2溶液的溶质质量分数越大,产生的水雾越多。【问题2】为什么H2O2溶液的溶质质量分数越大水雾越多呢?【实验2】分别向三只烧杯依次加入MnO2和溶质质量分数的不同H2O2溶液测定温度变化。 H2O溶液 5% 10% 30% 温度变化曲线 MnO2-|||-A-|||-200mL-|||-H2O2溶液-|||-甲 乙 乙 MnO2-|||-A-|||-200mL-|||-H2O2溶液-|||-甲 乙 乙 MnO2-|||-A-|||-200mL-|||-H2O2溶液-|||-甲 乙 乙 【解释与结论】(1)该对比实验过程中不需要控制的条件是 ____ 。A.H2O2溶液的初始温度相同 B.反应开始的时间相同 C.二氧化锰的质量相同(2)根据实验2,可得出的一个结论是 ____ 。
某化学兴趣小组做了如图所示实验,当向乙烧杯中依次加入MnO2和H2O2溶液时,发现有大量气泡产生,并产生大量白雾,蜡烛燃烧更旺,但过一会儿逐渐熄灭。而甲烧杯中蜡烛一直持续燃烧。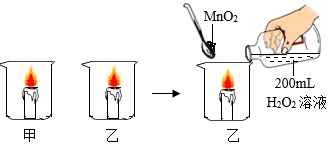
【知识回忆】写出过氧化氢分解产生氧气的化学方程式: ____ 。
【问题1】导致乙烧杯中蜡烛熄灭的原因是什么?
【作出猜想】猜想一:燃烧产生的CO2使蜡烛熄灭;
猜想二:白雾是水雾导致蜡烛熄灭;
小组同学经过讨论,排除了猜想一,其理由是 ____ 。
【实验1】向一只装有燃者蜡烛的烧杯中加入100℃水,另一只依次加入MnO2和H2O2溶液,若观察到 ____ 的现象,则猜想二正确。
【查阅资料】水雾产生与H2O2溶液的溶质质量分数大小有关,并且H2O2溶液的溶质质量分数越大,产生的水雾越多。
【问题2】为什么H2O2溶液的溶质质量分数越大水雾越多呢?
【实验2】分别向三只烧杯依次加入MnO2和溶质质量分数的不同H2O2溶液测定温度变化。
【解释与结论】
(1)该对比实验过程中不需要控制的条件是 ____ 。
A.H2O2溶液的初始温度相同 B.反应开始的时间相同 C.二氧化锰的质量相同
(2)根据实验2,可得出的一个结论是 ____ 。

【知识回忆】写出过氧化氢分解产生氧气的化学方程式: ____ 。
【问题1】导致乙烧杯中蜡烛熄灭的原因是什么?
【作出猜想】猜想一:燃烧产生的CO2使蜡烛熄灭;
猜想二:白雾是水雾导致蜡烛熄灭;
小组同学经过讨论,排除了猜想一,其理由是 ____ 。
【实验1】向一只装有燃者蜡烛的烧杯中加入100℃水,另一只依次加入MnO2和H2O2溶液,若观察到 ____ 的现象,则猜想二正确。
【查阅资料】水雾产生与H2O2溶液的溶质质量分数大小有关,并且H2O2溶液的溶质质量分数越大,产生的水雾越多。
【问题2】为什么H2O2溶液的溶质质量分数越大水雾越多呢?
【实验2】分别向三只烧杯依次加入MnO2和溶质质量分数的不同H2O2溶液测定温度变化。
| H2O溶液 | 5% | 10% | 30% |
| 温度变化曲线 | 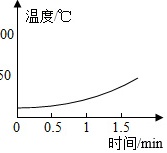 |
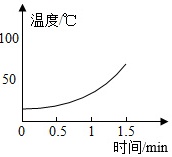 |
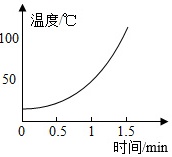 |
(1)该对比实验过程中不需要控制的条件是 ____ 。
A.H2O2溶液的初始温度相同 B.反应开始的时间相同 C.二氧化锰的质量相同
(2)根据实验2,可得出的一个结论是 ____ 。
题目解答
答案
解:【知识回忆】
过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑。
故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑。
【作出猜想】
小组同学经过讨论,排除了猜想一,其理由是甲中蜡烛燃烧也生成二氧化碳。
故填:甲中蜡烛燃烧也生成二氧化碳。
【实验1】
向一只装有燃者蜡烛的烧杯中加入100℃水,另一只依次加入MnO2和H2O2溶液,若观察到加入100℃水的烧杯中蜡烛熄灭,则猜想二正确。
故填:加入100℃水的烧杯中蜡烛熄灭。
【解释与结论】
(1)该对比实验过程中不需要控制的条件是反应开始的时间,需要控制的条件是H2O2溶液的初始温度相同、二氧化锰的质量相同,便于对比。
故填:B。
(2)根据实验2可知,过氧化氢溶液质量分数越大,单位时间内温度升高越快,可得出的一个结论是过氧化氢溶液质量分数越大,单位时间内反应放热越多。
故填:过氧化氢溶液质量分数越大,单位时间内反应放热越多。
过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑。
故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑。
【作出猜想】
小组同学经过讨论,排除了猜想一,其理由是甲中蜡烛燃烧也生成二氧化碳。
故填:甲中蜡烛燃烧也生成二氧化碳。
【实验1】
向一只装有燃者蜡烛的烧杯中加入100℃水,另一只依次加入MnO2和H2O2溶液,若观察到加入100℃水的烧杯中蜡烛熄灭,则猜想二正确。
故填:加入100℃水的烧杯中蜡烛熄灭。
【解释与结论】
(1)该对比实验过程中不需要控制的条件是反应开始的时间,需要控制的条件是H2O2溶液的初始温度相同、二氧化锰的质量相同,便于对比。
故填:B。
(2)根据实验2可知,过氧化氢溶液质量分数越大,单位时间内温度升高越快,可得出的一个结论是过氧化氢溶液质量分数越大,单位时间内反应放热越多。
故填:过氧化氢溶液质量分数越大,单位时间内反应放热越多。
解析
步骤 1:知识回忆
过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应的化学方程式:2H_2O_2$\frac{\underline{\;MnO_2\;}}{\;}$2H_2O+O_2↑。
步骤 2:问题1
导致乙烧杯中蜡烛熄灭的原因是白雾是水雾导致蜡烛熄灭。
步骤 3:作出猜想
小组同学经过讨论,排除了猜想一,其理由是甲中蜡烛燃烧也生成二氧化碳。
步骤 4:实验1
向一只装有燃者蜡烛的烧杯中加入100℃水,另一只依次加入MnO_2和H_2O_2溶液,若观察到加入100℃水的烧杯中蜡烛熄灭,则猜想二正确。
步骤 5:解释与结论
(1)该对比实验过程中不需要控制的条件是反应开始的时间,需要控制的条件是H_2O_2溶液的初始温度相同、二氧化锰的质量相同,便于对比。
(2)根据实验2可知,过氧化氢溶液质量分数越大,单位时间内温度升高越快,可得出的一个结论是过氧化氢溶液质量分数越大,单位时间内反应放热越多。
过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应的化学方程式:2H_2O_2$\frac{\underline{\;MnO_2\;}}{\;}$2H_2O+O_2↑。
步骤 2:问题1
导致乙烧杯中蜡烛熄灭的原因是白雾是水雾导致蜡烛熄灭。
步骤 3:作出猜想
小组同学经过讨论,排除了猜想一,其理由是甲中蜡烛燃烧也生成二氧化碳。
步骤 4:实验1
向一只装有燃者蜡烛的烧杯中加入100℃水,另一只依次加入MnO_2和H_2O_2溶液,若观察到加入100℃水的烧杯中蜡烛熄灭,则猜想二正确。
步骤 5:解释与结论
(1)该对比实验过程中不需要控制的条件是反应开始的时间,需要控制的条件是H_2O_2溶液的初始温度相同、二氧化锰的质量相同,便于对比。
(2)根据实验2可知,过氧化氢溶液质量分数越大,单位时间内温度升高越快,可得出的一个结论是过氧化氢溶液质量分数越大,单位时间内反应放热越多。