题目
油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:(1)已知下列反应的热化学方程式:①2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)ΔH1=-1036kJ•mol-1②4H2S(g)+2SO2(g)═3S2(g)+4H2O(g)ΔH2=94kJ•mol-1③2H2(g)+O2(g)═2H2O(g)ΔH3=-484kJ•mol-1计算H2S热分解反应④2H2S(g)═S2(g)+2H2(g)的ΔH4= ____ kJ•mol-1。(2)较普遍采用的H2S处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是,利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是 ____ ,缺点是 ____ 。(3)在1470K、100kPa反应条件下,将n(H2S):n(Ar)=1:4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为 ____ ,平衡常数Kp= ____ kPa。(4)在1373K、100kPa反应条件下,对于n(H2S):n(Ar)分别为4:1、1:1、1:4、1:9、1:19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如图所示。60. ē-|||-56.-|||-C-|||-a-|||-12- 过-|||-8-|||-4.-|||-0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 1.8-|||-时间/s①n(H2S):n(Ar)越小,H2S平衡转化率 ____ ,理由是 ____ 。②n(H2S):n(Ar)=1:9对应图中曲线 ____ ,计算其在0~0.1s之间,H2S分压的平均变化率为 ____ kPa⋅s-1。
油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)ΔH1=-1036kJ•mol-1
②4H2S(g)+2SO2(g)═3S2(g)+4H2O(g)ΔH2=94kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)ΔH3=-484kJ•mol-1
计算H2S热分解反应④2H2S(g)═S2(g)+2H2(g)的ΔH4= ____ kJ•mol-1。
(2)较普遍采用的H2S处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是,利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是 ____ ,缺点是 ____ 。
(3)在1470K、100kPa反应条件下,将n(H2S):n(Ar)=1:4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为 ____ ,平衡常数Kp= ____ kPa。
(4)在1373K、100kPa反应条件下,对于n(H2S):n(Ar)分别为4:1、1:1、1:4、1:9、1:19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如图所示。
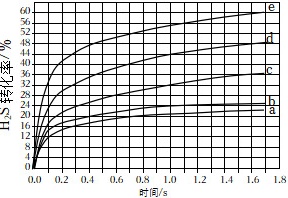
①n(H2S):n(Ar)越小,H2S平衡转化率 ____ ,理由是 ____ 。
②n(H2S):n(Ar)=1:9对应图中曲线 ____ ,计算其在0~0.1s之间,H2S分压的平均变化率为 ____ kPa⋅s-1。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)ΔH1=-1036kJ•mol-1
②4H2S(g)+2SO2(g)═3S2(g)+4H2O(g)ΔH2=94kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)ΔH3=-484kJ•mol-1
计算H2S热分解反应④2H2S(g)═S2(g)+2H2(g)的ΔH4= ____ kJ•mol-1。
(2)较普遍采用的H2S处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是,利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是 ____ ,缺点是 ____ 。
(3)在1470K、100kPa反应条件下,将n(H2S):n(Ar)=1:4的混合气进行H2S热分解反应。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为 ____ ,平衡常数Kp= ____ kPa。
(4)在1373K、100kPa反应条件下,对于n(H2S):n(Ar)分别为4:1、1:1、1:4、1:9、1:19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如图所示。

①n(H2S):n(Ar)越小,H2S平衡转化率 ____ ,理由是 ____ 。
②n(H2S):n(Ar)=1:9对应图中曲线 ____ ,计算其在0~0.1s之间,H2S分压的平均变化率为 ____ kPa⋅s-1。
题目解答
答案
解:(1)已知:①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1=-1036kJ/mol
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g)△H2=+94kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H3=-484kJ/mol
根据盖斯定律(①+②)×$\frac{1}{3}$-③即得到2H2S(g)=S2(g)+2H2(g)的△H4=(-1036+94)kJ/mol×$\frac{1}{3}$+484kJ/mol=+170 kJ/mol,
故答案为:+170;
(2)根据盖斯定律(①+②)×$\frac{1}{3}$可得2H2S(g)+O2(g)=S2(g)+2H2O(g)△H=(-1036+94)kJ/mol×$\frac{1}{3}$=-314kJ/mol,因此,克劳斯工艺的总反应是放热反应;根据硫化氢分解的化学方程式可知,高温热分解方法在生成单质硫的同时还有氢气生成,因此,高温热分解方法的优点是:可以获得氢气作燃料;但由于高温分解H2S会消耗大量能量,所以其缺点是耗能高,
故答案为:副产物氢气可作燃料;耗能高;
(3)假设在该条件下,硫化氢和氩的起始投料的物质的量分别为1mol和4mol,根据三段式可知:
2H2S(g)═S2(g)+2H2(g)
起始(mol) 1 0 0
变化(mol) x 0.5x x
平衡(mol) 1-x 0.5x x
平衡时H2S和H2的分压相等,则二者的物质的量相等,即1-x=x,解得x=0.5,所以H2S的平衡转化率为$\frac{0.5mol}{1mol}×100%$=50%,所以平衡常数Kp═$\frac{p({S}_{2})×{p}^{2}({H}_{2})}{{p}^{2}({H}_{2}S)}$=$\frac{\frac{0.25}{5.25}×100kPa×(\frac{0.5}{5.25}×100kPa)^{2}}{(\frac{0.5}{5.25}×100kPa)^{2}}$≈4.76kPa,
故答案为:50%;4.76;
(4)①由于正反应是体积增大的可逆反应,n(H2S):n(Ar)越小,H2S的分压越小,相当于降低压强,平衡向正反应方向移动,因此H2S平衡转化率越高,
故答案为:越高;n(H2S):n(Ar)越小,H2S的分压越小,平衡向正反应方向进行,H2S平衡转化率越高;
②n(H2S):n(Ar)越小,H2S平衡转化率越高,所以n(H2S):n(Ar)=1:9,对应的曲线是d;根据图像可知n(H2S):n(Ar)=1:9,反应进行到0.1s时H2S转化率为0.24,假设在该条件下,硫化氢和氩的起始投料的物质的量分别为1mol和9mol,则根据三段式可知:
2H2S(g)═S2(g)+2H2(g)
起始(mol) 1 0 0
变化(mol) 0.24 0.12 0.24
平衡(mol) 0.76 0.12 0.24
此时H2S的压强为$\frac{0.76mol}{(0.76+0.12+0.24+9)mol}×100kPa$≈7.51kPa,H2S的起始压强为10kPa,所以H2S分压的平均变化率为$\frac{10kPa-7.51kPa}{0.1s}$=24.9kPa•s-1,
故答案为:d;24.9。
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g)△H2=+94kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H3=-484kJ/mol
根据盖斯定律(①+②)×$\frac{1}{3}$-③即得到2H2S(g)=S2(g)+2H2(g)的△H4=(-1036+94)kJ/mol×$\frac{1}{3}$+484kJ/mol=+170 kJ/mol,
故答案为:+170;
(2)根据盖斯定律(①+②)×$\frac{1}{3}$可得2H2S(g)+O2(g)=S2(g)+2H2O(g)△H=(-1036+94)kJ/mol×$\frac{1}{3}$=-314kJ/mol,因此,克劳斯工艺的总反应是放热反应;根据硫化氢分解的化学方程式可知,高温热分解方法在生成单质硫的同时还有氢气生成,因此,高温热分解方法的优点是:可以获得氢气作燃料;但由于高温分解H2S会消耗大量能量,所以其缺点是耗能高,
故答案为:副产物氢气可作燃料;耗能高;
(3)假设在该条件下,硫化氢和氩的起始投料的物质的量分别为1mol和4mol,根据三段式可知:
2H2S(g)═S2(g)+2H2(g)
起始(mol) 1 0 0
变化(mol) x 0.5x x
平衡(mol) 1-x 0.5x x
平衡时H2S和H2的分压相等,则二者的物质的量相等,即1-x=x,解得x=0.5,所以H2S的平衡转化率为$\frac{0.5mol}{1mol}×100%$=50%,所以平衡常数Kp═$\frac{p({S}_{2})×{p}^{2}({H}_{2})}{{p}^{2}({H}_{2}S)}$=$\frac{\frac{0.25}{5.25}×100kPa×(\frac{0.5}{5.25}×100kPa)^{2}}{(\frac{0.5}{5.25}×100kPa)^{2}}$≈4.76kPa,
故答案为:50%;4.76;
(4)①由于正反应是体积增大的可逆反应,n(H2S):n(Ar)越小,H2S的分压越小,相当于降低压强,平衡向正反应方向移动,因此H2S平衡转化率越高,
故答案为:越高;n(H2S):n(Ar)越小,H2S的分压越小,平衡向正反应方向进行,H2S平衡转化率越高;
②n(H2S):n(Ar)越小,H2S平衡转化率越高,所以n(H2S):n(Ar)=1:9,对应的曲线是d;根据图像可知n(H2S):n(Ar)=1:9,反应进行到0.1s时H2S转化率为0.24,假设在该条件下,硫化氢和氩的起始投料的物质的量分别为1mol和9mol,则根据三段式可知:
2H2S(g)═S2(g)+2H2(g)
起始(mol) 1 0 0
变化(mol) 0.24 0.12 0.24
平衡(mol) 0.76 0.12 0.24
此时H2S的压强为$\frac{0.76mol}{(0.76+0.12+0.24+9)mol}×100kPa$≈7.51kPa,H2S的起始压强为10kPa,所以H2S分压的平均变化率为$\frac{10kPa-7.51kPa}{0.1s}$=24.9kPa•s-1,
故答案为:d;24.9。