题目
煤的成分分析结果(质量分数)如下:S:0.6%;H:3.7%;C:79.5%;N:0.9%;O:4.7%;灰分:10.6%。在空气过剩20%条件下完全燃烧。计算烟气中SO2的浓度。
煤的成分分析结果(质量分数)如下:S:0.6%;H:3.7%;C:79.5%;N:0.9%;O:4.7%;灰分:10.6%。在空气过剩20%条件下完全燃烧。计算烟气中SO2的浓度。
题目解答
答案
解:按燃烧1kg煤计算
重量(g) 摩尔数(mol) 需氧数(mol)
C 795 66.25 66.25
H 31.125 15.5625 7.78
S 6 0.1875 0.1875
H2O 52.875 2.94 0
设干空气中N2:O2体积比为3.78:1,
所需理论空气量为:4.78×(66.25+7.78+0.1875)=354.76mol/kg煤。
理论烟气量CO2: 66.25mol,SO2 :0.1875mol,H2O :15.5625+2.94=18.50mol
N2: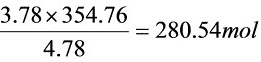
总计66.25+18.50+0.1875+280.54=365.48mol/kg煤
实际烟气量365.48+0.2×354.76=436.43mol/kg煤
SO2浓度为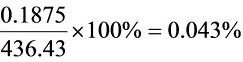
解析
步骤 1:计算煤中各元素的摩尔数
根据煤的成分分析结果,计算出各元素的摩尔数。首先,需要将质量分数转换为摩尔数。例如,对于碳(C),其质量分数为79.5%,摩尔质量为12g/mol,因此,1kg煤中碳的摩尔数为795g / 12g/mol = 66.25mol。同理,可以计算出其他元素的摩尔数。
步骤 2:计算所需理论空气量
根据各元素的摩尔数,计算出所需理论空气量。例如,碳(C)的摩尔数为66.25mol,需要的氧气摩尔数为66.25mol。同理,可以计算出其他元素所需的氧气摩尔数。然后,根据干空气中N2:O2体积比为3.78:1,计算出所需理论空气量。
步骤 3:计算理论烟气量
根据各元素的摩尔数,计算出理论烟气量。例如,碳(C)的摩尔数为66.25mol,生成的CO2摩尔数为66.25mol。同理,可以计算出其他元素生成的烟气摩尔数。然后,根据理论空气量,计算出理论烟气量。
步骤 4:计算实际烟气量
根据理论烟气量和空气过剩20%条件,计算出实际烟气量。
步骤 5:计算SO2浓度
根据实际烟气量和SO2摩尔数,计算出SO2浓度。
根据煤的成分分析结果,计算出各元素的摩尔数。首先,需要将质量分数转换为摩尔数。例如,对于碳(C),其质量分数为79.5%,摩尔质量为12g/mol,因此,1kg煤中碳的摩尔数为795g / 12g/mol = 66.25mol。同理,可以计算出其他元素的摩尔数。
步骤 2:计算所需理论空气量
根据各元素的摩尔数,计算出所需理论空气量。例如,碳(C)的摩尔数为66.25mol,需要的氧气摩尔数为66.25mol。同理,可以计算出其他元素所需的氧气摩尔数。然后,根据干空气中N2:O2体积比为3.78:1,计算出所需理论空气量。
步骤 3:计算理论烟气量
根据各元素的摩尔数,计算出理论烟气量。例如,碳(C)的摩尔数为66.25mol,生成的CO2摩尔数为66.25mol。同理,可以计算出其他元素生成的烟气摩尔数。然后,根据理论空气量,计算出理论烟气量。
步骤 4:计算实际烟气量
根据理论烟气量和空气过剩20%条件,计算出实际烟气量。
步骤 5:计算SO2浓度
根据实际烟气量和SO2摩尔数,计算出SO2浓度。