题目
一系统有10 molAr(g),可看作理想气体,已知Ar(g)的CV,该系统从始态273 K 100 kPa变到终态398 K 1000 kPa,设计3种不同的路径分别计算该过程的熵变。比较结果,说明什么问题?
一系统有10 molAr(g),可看作理想气体,已知Ar(g)的CV,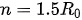 该系统从始态273 K 100 kPa变到终态398 K 1000 kPa,设计3种不同的路径分别计算该过程的熵变。比较结果,说明什么问题?
该系统从始态273 K 100 kPa变到终态398 K 1000 kPa,设计3种不同的路径分别计算该过程的熵变。比较结果,说明什么问题?
题目解答
答案
需要计算始态和终态的体积。
对于始态(273 K, 100 kPa),有:
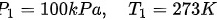
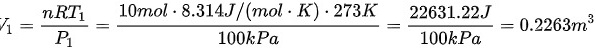
对于终态(398 K, 1000 kPa),有:
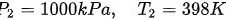
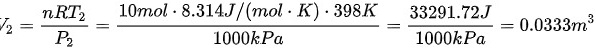
现在可以选择三条不同的路径来计算熵变。
路径1:等压过程
在等压过程中,压力保持不变,可以使用以下公式计算熵变:
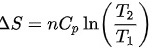
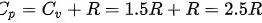
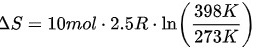
路径2:等温过程
在等温过程中,温度保持不变,可以使用以下公式计算熵变:
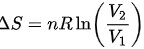
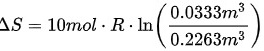
路径3:等容过程
在等容过程中,体积保持不变,可以使用以下公式计算熵变:
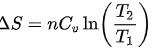
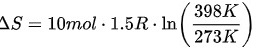
对比这三条路径的熵变,可以看到即使路径不同,熵变的数值是相同的。这验证了熵是一个状态函数,它的变化只取决于系统的始态和终态,而与过程无关。这也说明了热力学第二定律的重要性和应用。
解析
步骤 1:计算始态和终态的体积
根据理想气体状态方程PV=nRT,可以计算始态和终态的体积。
始态:${P}_{1}=100kPa$,${T}_{1}=273K$,${n}=10mol$,${R}=8.314J/(mol\cdot K)$
终态:${P}_{2}=1000kPa$,${T}_{2}=398K$,${n}=10mol$,${R}=8.314J/(mol\cdot K)$
步骤 2:计算等压过程的熵变
在等压过程中,压力保持不变,可以使用以下公式计算熵变:
$\Delta S=n{C}_{p}\ln (\dfrac {{T}_{2}}{{T}_{1}})$
其中${C}_{p}={C}_{V}+R=1.5R+R=2.5R$
步骤 3:计算等温过程的熵变
在等温过程中,温度保持不变,可以使用以下公式计算熵变:
$\Delta S=nR\ln (\dfrac {{V}_{2}}{{V}_{1}})$
步骤 4:计算等容过程的熵变
在等容过程中,体积保持不变,可以使用以下公式计算熵变:
$\Delta S=n{C}_{V}\ln (\dfrac {{T}_{2}}{{T}_{1}})$
步骤 5:比较结果,说明问题
比较这三条路径的熵变,可以看到即使路径不同,熵变的数值是相同的。这验证了熵是一个状态函数,它的变化只取决于系统的始态和终态,而与过程无关。这也说明了热力学第二定律的重要性和应用。
根据理想气体状态方程PV=nRT,可以计算始态和终态的体积。
始态:${P}_{1}=100kPa$,${T}_{1}=273K$,${n}=10mol$,${R}=8.314J/(mol\cdot K)$
终态:${P}_{2}=1000kPa$,${T}_{2}=398K$,${n}=10mol$,${R}=8.314J/(mol\cdot K)$
步骤 2:计算等压过程的熵变
在等压过程中,压力保持不变,可以使用以下公式计算熵变:
$\Delta S=n{C}_{p}\ln (\dfrac {{T}_{2}}{{T}_{1}})$
其中${C}_{p}={C}_{V}+R=1.5R+R=2.5R$
步骤 3:计算等温过程的熵变
在等温过程中,温度保持不变,可以使用以下公式计算熵变:
$\Delta S=nR\ln (\dfrac {{V}_{2}}{{V}_{1}})$
步骤 4:计算等容过程的熵变
在等容过程中,体积保持不变,可以使用以下公式计算熵变:
$\Delta S=n{C}_{V}\ln (\dfrac {{T}_{2}}{{T}_{1}})$
步骤 5:比较结果,说明问题
比较这三条路径的熵变,可以看到即使路径不同,熵变的数值是相同的。这验证了熵是一个状态函数,它的变化只取决于系统的始态和终态,而与过程无关。这也说明了热力学第二定律的重要性和应用。