习题45 已知C2H5 OH(1)在25℃时的标准摩尔燃烧焓为 -1367kJcdot (mol)^-1 ,试用-|||-(O)_(2)(g) 和H2O(1)在·25℃时的生成焓,计算C 2H5 OH(1)在25℃时的标准摩尔生成焓。-|||-[答案: -277.4kJcdot (mol)^-1

题目解答
答案
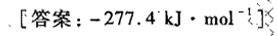
解析
考查要点:本题主要考查燃烧焓与生成焓的关系,以及如何利用热化学方程式的叠加原理进行计算。
解题核心思路:
- 燃烧焓的定义:物质完全燃烧生成稳定氧化物(CO₂和H₂O)的焓变。
- 生成焓的定义:从元素的标准态生成1 mol物质的焓变。
- 热化学方程式叠加原理:燃烧焓可表示为产物生成焓与反应物生成焓的差值。
破题关键点:
- 正确写出乙醇燃烧的热化学方程式。
- 利用燃烧焓与生成焓的关系式,建立方程求解乙醇的生成焓。
- 注意单位一致性及生成焓数据的正确代入。
步骤1:写出乙醇燃烧的热化学方程式
乙醇燃烧的反应为:
$\text{C}_2\text{H}_5\text{OH}(l) + 3\text{O}_2(g) \rightarrow 2\text{CO}_2(g) + 3\text{H}_2\text{O}(l)$
其标准摩尔燃烧焓为 $\Delta_c H^\circ = -1367 \, \text{kJ/mol}$。
步骤2:建立燃烧焓与生成焓的关系式
根据热化学方程式叠加原理,燃烧焓可表示为:
$\Delta_c H^\circ = \sum \Delta_f H^\circ (\text{产物}) - \sum \Delta_f H^\circ (\text{反应物})$
其中,氧气为标准态,生成焓为 $0$,代入得:
$-1367 = 2\Delta_f H^\circ (\text{CO}_2) + 3\Delta_f H^\circ (\text{H}_2\text{O}) - \Delta_f H^\circ (\text{C}_2\text{H}_5\text{OH})$
步骤3:代入已知生成焓数据
已知:
- $\Delta_f H^\circ (\text{CO}_2) = -393.5 \, \text{kJ/mol}$
- $\Delta_f H^\circ (\text{H}_2\text{O}) = -285.8 \, \text{kJ/mol}$
代入方程:
$-1367 = 2(-393.5) + 3(-285.8) - \Delta_f H^\circ (\text{C}_2\text{H}_5\text{OH})$
步骤4:计算乙醇的生成焓
计算右侧:
$2(-393.5) = -787, \quad 3(-285.8) = -857.4$
总和为:
$-787 - 857.4 = -1644.4$
方程变形为:
$-1367 = -1644.4 - \Delta_f H^\circ (\text{C}_2\text{H}_5\text{OH})$
解得:
$\Delta_f H^\circ (\text{C}_2\text{H}_5\text{OH}) = -1644.4 + 1367 = -277.4 \, \text{kJ/mol}$