题目
5.现有中学化学中常见的八种物质:-|||-①固体氢氧化钡 ②石墨碳棒 ③纯醋酸 ④液-|||-态氯化氢 ⑤硫酸氢钾固体 ⑥熔融氯化钠-|||-⑦蔗糖 ⑧碳酸钠粉末-|||-请用序号填空。-|||-(1)上述状态下可导电的是 __ 属于-|||-非电解质的是 __-|||-(2)属于酸的是 __ 属于碱的是 __-|||-属于盐的是 __-|||-(3)写出①④⑤⑧在水溶液中的电离方程式:-|||-① __ ;-|||-④ __ ;-|||-⑤ __ ;-|||-⑧ __

题目解答
答案
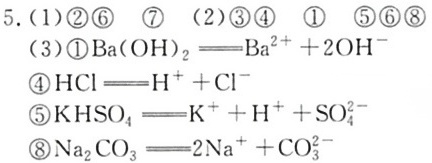
解析
考查要点:
- 物质导电性的判断:根据物质状态判断是否含有自由移动的离子或电子。
- 电解质与非电解质的区分:明确两者的定义及物质类别(化合物、单质、混合物)。
- 物质分类:酸、碱、盐的判断依据电离后产生的离子类型。
- 电离方程式的书写:掌握不同物质在水溶液中的电离方式,注意固体、液体状态的处理。
解题核心思路:
- 导电性:金属单质(如石墨)或熔融/溶解的电解质(如熔融NaCl)可导电。
- 非电解质:必须是化合物,且本身不能导电,溶于水也不导电(如蔗糖)。
- 物质分类:酸(H+唯一阳离子)、碱(金属阳离子+OH⁻)、盐(金属阳离子+酸根)。
- 电离方程式:固体或液体状态下物质需先溶解再电离,方程式需配平。
第(1)题
可导电的物质
- ②石墨碳棒:金属单质,含有自由电子,能导电。
- ⑥熔融氯化钠:熔融状态下离解为自由移动的Na⁺和Cl⁻,能导电。
其他物质:固体、液体或固态化合物无法形成自由离子,不导电。
非电解质
- ⑦蔗糖:化合物,溶于水不导电,属于非电解质。
- 其他物质:③纯醋酸、④液态HCl、⑤硫酸氢钾、⑧碳酸钠均为电解质。
第(2)题
酸
- ③纯醋酸:电离生成CH₃COO⁻和H⁺。
- ④液态氯化氢:HCl溶于水电离为H⁺和Cl⁻,属于酸。
碱
- ①固体氢氧化钡:电离生成Ba²⁺和OH⁻。
盐
- ⑤硫酸氢钾:电离生成K⁺、H⁺和SO₄²⁻(本质为盐)。
- ⑥熔融氯化钠:电离生成Na⁺和Cl⁻。
- ⑧碳酸钠:电离生成Na⁺和CO₃²⁻。
第(3)题
①固体氢氧化钡
溶解后完全电离:
$Ba(OH)_2 \rightarrow Ba^{2+} + 2OH^-$
④液态氯化氢
溶于水电离:
$HCl \rightarrow H^+ + Cl^-$
⑤硫酸氢钾
完全离解为三种离子:
$KHSO_4 \rightarrow K^+ + H^+ + SO_4^{2-}$
⑧碳酸钠
完全电离:
$Na_2CO_3 \rightarrow 2Na^+ + CO_3^{2-}$