题目
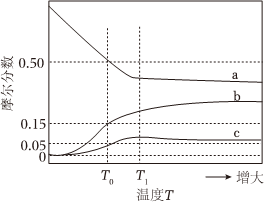
器 0.50-|||-0.15-|||-0.05 c-|||-T0 T1 →增大-|||-温度T水煤气是H2的主要来源。研究CaO对C—H2O体系制H2的影响,涉及主要反应如下:C(s)+H2O(g)⇌CO(g)+H2(g) (Ⅰ) ΔH1>0CO(g)+H2O(g)⇌CO2(g)+H2(g) (Ⅱ) ΔH2<0CaO(s)+CO2(g)⇌CaCO3(s) (Ⅲ) ΔH3<0回答下列问题:(1)C(s)+CaO(s)+2H2O(g)⇌CaCO3(s)+2H2(g)的焓变ΔH= ____ (用代数式表示)。(2)压力p下,C—H2O—CaO体系达平衡后,图示温度范围内C(s)已完全反应。CaCO3(s)在T1温度时完全分解,气相中CO、CO2和H2摩尔分数温度的变化关系如图所示,则a线对应物种为 ____ (填化学式)。当温度高于T1时,随温度升高c线对应物种摩尔分数逐渐降低的原因是 ____ 。(3)压力p下,温度为T0时,图示三种气体的摩尔分数分别为0.50、0.15、0.05,则反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数Kp= ____ ;此时气体总物质的量为4.0mol。则CaCO3(s)的物质的量为 ____ mol;若向平衡体系中通入少量CO2(g),重新达平衡后,分压p(CO2)将 ____ (填“增大”“减小”或“不变”),p(CO)将 ____ (填“增大”“减小”或“不变”)。
 水煤气是H2的主要来源。研究CaO对C—H2O体系制H2的影响,涉及主要反应如下:
水煤气是H2的主要来源。研究CaO对C—H2O体系制H2的影响,涉及主要反应如下:C(s)+H2O(g)⇌CO(g)+H2(g) (Ⅰ) ΔH1>0
CO(g)+H2O(g)⇌CO2(g)+H2(g) (Ⅱ) ΔH2<0
CaO(s)+CO2(g)⇌CaCO3(s) (Ⅲ) ΔH3<0
回答下列问题:
(1)C(s)+CaO(s)+2H2O(g)⇌CaCO3(s)+2H2(g)的焓变ΔH= ____ (用代数式表示)。
(2)压力p下,C—H2O—CaO体系达平衡后,图示温度范围内C(s)已完全反应。CaCO3(s)在T1温度时完全分解,气相中CO、CO2和H2摩尔分数温度的变化关系如图所示,则a线对应物种为 ____ (填化学式)。当温度高于T1时,随温度升高c线对应物种摩尔分数逐渐降低的原因是 ____ 。
(3)压力p下,温度为T0时,图示三种气体的摩尔分数分别为0.50、0.15、0.05,则反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数Kp= ____ ;此时气体总物质的量为4.0mol。则CaCO3(s)的物质的量为 ____ mol;若向平衡体系中通入少量CO2(g),重新达平衡后,分压p(CO2)将 ____ (填“增大”“减小”或“不变”),p(CO)将 ____ (填“增大”“减小”或“不变”)。
题目解答
答案
(1)根据题意有反应Ⅰ:C(s)+H2O(g)⇌CO(g)+H2(g) ΔH1>0,反应Ⅱ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2<0,反应Ⅲ:CaO(s)+CO2(g)⇌CaCO3(s) ΔH3<0,根据盖斯定律,Ⅰ+Ⅱ+Ⅲ可得反应:C(s)+CaO(s)+2H2O(g)⇌CaCO3(s)+2H2(g)ΔH,则ΔH=ΔH1+ΔH2+ΔH3,
故答案为:ΔH1+ΔH2+ΔH3;
(2)图示温度范围内C(s)已完全反应,则反应Ⅰ已经完全进行,反应Ⅱ和Ⅲ全为放热反应,从开始到T1,温度不断升高,反应Ⅱ和Ⅲ逆向移动,依据反应Ⅱ,H2量减小,摩尔分数减小,CO量升高,摩尔分数升高,且两者的摩尔分数相同,所以a线对应H2的摩尔分数,c线对应CO2的摩尔分数,从开始到T1,CO2的摩尔分数升高,反应占主导,当温度高于T1时,CaCO3(s)已完全分解,只发生反应Ⅱ,所以CO2的摩尔分数减小,
故答案为:H2;当温度高于T1时,CaCO3(s)已完全分解,只发生反应Ⅱ,所以CO2的摩尔分数减小;
(3)压力p下,温度为T0时,图示三种气体的摩尔分数分别为0.50、0.15、0.05,则反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数Kp=$\frac{p(C{O}_{2})p({H}_{2})}{p(CO)p({H}_{2}O)}$=$\frac{0.05p×0.5p}{0.15p×0.3p}$=$\frac{5}{9}$,设起始状态有1mol C(s),xmol H2O,反应Ⅰ完全进行,则有三段式:
C(s)+H2O(g)⇌CO(g)+H2(g)
起始量(mol) 1 x 0 0
变化量(mol) 1 1 1 1
平衡量(mol) 0 x-1 1 1
CO(g)+H2O(g)⇌CO2(g)+H2(g)
变化量(mol) a a a a
CaO(s)+CO2(g)⇌CaCO3(s)
变化量(mol) b b
根据平衡时,H2、CO、CO2摩尔分数分别为0.50、0.15、0.05,则有:$\frac{1+a}{x+1-b}$=0.5、$\frac{1-a}{x+1-b}$=0.15、$\frac{a-b}{x+1-b}$=0.05,解得:x=$\frac{32}{13}$,a=$\frac{7}{13}$,b=$\frac{5}{13}$,则n(总)=x+1-b=$\frac{32}{13}+1-\frac{5}{13}$=$\frac{40}{13}$,由于平衡时,n(总)=4mol,则$\frac{40}{13}y$=4,y=$\frac{13}{10}$,则n(CaCO3)=b×y=$\frac{5}{13}×\frac{13}{10}$=0.5,若向平衡体系中通入少量CO2(g),重新达平衡后,反应CaO(s)+CO2(g)⇌CaCO3(s)的Kp=$\frac{1}{p(C{O}_{2})}$,温度不变,Kp变,分压p(CO2)将 不变,则反应Ⅱ的Kp也不变,p(CO)也不会改变,
故答案为:$\frac{5}{9}$;0.5;不变;不变。
故答案为:ΔH1+ΔH2+ΔH3;
(2)图示温度范围内C(s)已完全反应,则反应Ⅰ已经完全进行,反应Ⅱ和Ⅲ全为放热反应,从开始到T1,温度不断升高,反应Ⅱ和Ⅲ逆向移动,依据反应Ⅱ,H2量减小,摩尔分数减小,CO量升高,摩尔分数升高,且两者的摩尔分数相同,所以a线对应H2的摩尔分数,c线对应CO2的摩尔分数,从开始到T1,CO2的摩尔分数升高,反应占主导,当温度高于T1时,CaCO3(s)已完全分解,只发生反应Ⅱ,所以CO2的摩尔分数减小,
故答案为:H2;当温度高于T1时,CaCO3(s)已完全分解,只发生反应Ⅱ,所以CO2的摩尔分数减小;
(3)压力p下,温度为T0时,图示三种气体的摩尔分数分别为0.50、0.15、0.05,则反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数Kp=$\frac{p(C{O}_{2})p({H}_{2})}{p(CO)p({H}_{2}O)}$=$\frac{0.05p×0.5p}{0.15p×0.3p}$=$\frac{5}{9}$,设起始状态有1mol C(s),xmol H2O,反应Ⅰ完全进行,则有三段式:
C(s)+H2O(g)⇌CO(g)+H2(g)
起始量(mol) 1 x 0 0
变化量(mol) 1 1 1 1
平衡量(mol) 0 x-1 1 1
CO(g)+H2O(g)⇌CO2(g)+H2(g)
变化量(mol) a a a a
CaO(s)+CO2(g)⇌CaCO3(s)
变化量(mol) b b
根据平衡时,H2、CO、CO2摩尔分数分别为0.50、0.15、0.05,则有:$\frac{1+a}{x+1-b}$=0.5、$\frac{1-a}{x+1-b}$=0.15、$\frac{a-b}{x+1-b}$=0.05,解得:x=$\frac{32}{13}$,a=$\frac{7}{13}$,b=$\frac{5}{13}$,则n(总)=x+1-b=$\frac{32}{13}+1-\frac{5}{13}$=$\frac{40}{13}$,由于平衡时,n(总)=4mol,则$\frac{40}{13}y$=4,y=$\frac{13}{10}$,则n(CaCO3)=b×y=$\frac{5}{13}×\frac{13}{10}$=0.5,若向平衡体系中通入少量CO2(g),重新达平衡后,反应CaO(s)+CO2(g)⇌CaCO3(s)的Kp=$\frac{1}{p(C{O}_{2})}$,温度不变,Kp变,分压p(CO2)将 不变,则反应Ⅱ的Kp也不变,p(CO)也不会改变,
故答案为:$\frac{5}{9}$;0.5;不变;不变。
解析
- 反应叠加与盖斯定律:第(1)题需将三个已知反应相加,得到目标反应的焓变ΔH,关键在于正确组合反应式并累加焓变。
- 平衡移动与图像分析:第(2)题需结合温度对放热反应的影响,分析各物质摩尔分数变化趋势,明确不同温度区间主导反应。
- 平衡常数计算与勒沙特列原理:第(3)题需利用分压计算平衡常数,通过物料守恒和平衡关系求解物质的量,判断外界干扰对平衡的影响。
第(1)题
目标反应:
$\text{C(s)} + \text{CaO(s)} + 2\text{H}_2\text{O(g)} \rightleftharpoons \text{CaCO}_3(s) + 2\text{H}_2(g)$
反应叠加:
将反应(Ⅰ)、(Ⅱ)、(Ⅲ)相加:
- 反应(Ⅰ)+(Ⅱ):$\text{C(s)} + 2\text{H}_2\text{O(g)} \rightleftharpoons \text{CO}_2(g) + 2\text{H}_2(g)$
- 加反应(Ⅲ):$\text{CaO(s)} + \text{CO}_2(g) \rightleftharpoons \text{CaCO}_3(s)$
总焓变:
$\Delta H = \Delta H_1 + \Delta H_2 + \Delta H_3$
第(2)题
第一空
关键分析:
- 在温度$T_0$到$T_1$范围内,反应(Ⅱ)和(Ⅲ)逆向进行,导致$\text{H}_2$摩尔分数下降,$\text{CO}$上升。
- 图中$a$线与$\text{CO}$变化趋势一致,对应$\text{CO}$;$c$线对应$\text{CO}_2$(因反应(Ⅲ)正向占优)。
第二空
原因:
当温度高于$T_1$时,$\text{CaCO}_3$完全分解,仅反应(Ⅱ)进行,$\text{CO}_2$被消耗,摩尔分数降低。
第(3)题
平衡常数$K_p$
分压计算:
$K_p = \frac{p(\text{CO}_2)p(\text{H}_2)}{p(\text{CO})p(\text{H}_2\text{O})} = \frac{0.05p \cdot 0.5p}{0.15p \cdot 0.3p} = \frac{5}{9}$
$\text{CaCO}_3$的物质的量
三段式分析:
设初始$\text{H}_2\text{O}$为$x$ mol,通过平衡关系解得总物质的量为$\frac{40}{13}y = 4$ mol,得$y = \frac{13}{10}$。
$\text{CaCO}_3$的物质的量为$b \cdot y = 0.5$ mol。
干扰分析
通入$\text{CO}_2$的影响:
- 反应(Ⅲ)平衡右移,$\text{CO}_2$分压不变(因$K_p$固定)。
- 反应(Ⅱ)中$\text{CO}_2$增加,$\text{CO}$分压不变($K_p$不变)。