题目
4.已知下列反应在1362K时的标准平衡常数:-|||-① _(2)(g)+dfrac (1)(2)(S)_(2)(g)leftharpoons (H)_(2)S(g) _(1)^theta =0.80-|||-② (H)_(2)(g)+S(O)_(2)(g)leftharpoons (H)_(2)S(g)+2(H)_(2)O(g) ; _(2)^theta =1.8times (10)^4-|||-计算反应 (H)_(2)(g)+2S(O)_(2)(g)leftharpoons (S)_(2)(g)+4(H)_(2)O(g) 在1362K时的标准平衡常数 ^theta 。

题目解答
答案
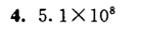
解析
本题考查化学平衡常数的计算,核心思路是利用已知反应的平衡常数,通过反应式的叠加关系推导目标反应的平衡常数。关键在于:
- 确定目标反应与已知反应的数学关系,即如何通过已知反应的组合(如倍数相加、相减等)得到目标反应;
- 平衡常数的运算规则:若反应式乘以系数$n$,平衡常数变为原值的$n$次方;若反应式相加,则平衡常数相乘;若反应式反转,则平衡常数取倒数。
反应关系推导
-
目标反应拆分:
目标反应为:
$4\text{H}_2(g) + 2\text{SO}_2(g) \rightleftharpoons \text{S}_2(g) + 4\text{H}_2\text{O}(g)$
需将其表示为已知反应①和②的组合。 -
调整已知反应:
- 反应②×2:
$6\text{H}_2(g) + 2\text{SO}_2(g) \rightleftharpoons 2\text{H}_2\text{S}(g) + 4\text{H}_2\text{O}(g)$
平衡常数为:
$K_2' = (K_2^\theta)^2 = (1.8 \times 10^4)^2$ - 反应①反转并×2:
$2\text{H}_2\text{S}(g) \rightleftharpoons 2\text{H}_2(g) + \text{S}_2(g)$
平衡常数为:
$K_1' = \left(\frac{1}{K_1^\theta}\right)^2 = \left(\frac{1}{0.80}\right)^2$
- 反应②×2:
-
叠加反应:
将调整后的两个反应相加,中间产物$\text{H}_2\text{S}$抵消,最终得到目标反应:
$4\text{H}_2(g) + 2\text{SO}_2(g) \rightleftharpoons \text{S}_2(g) + 4\text{H}_2\text{O}(g)$
平衡常数计算
根据平衡常数运算规则:
$K^\theta = K_2' \cdot K_1' = (1.8 \times 10^4)^2 \cdot \left(\frac{1}{0.80}\right)^2$
计算得:
$K^\theta = 5.1 \times 10^8$