有液相反应,在120℃时,正、逆反应的速率常数分别为k1=8[L/(mol.min)],k2.1.7[L/(mol.min)]。若反应在一全混釜式反应器中进行,其中物料容量为100L。二股进料流同时等流量导入反应器,其中一股含A物料3.0[mol/L],另一股含B物料2.0[mol/L],求当B的转化率为80%时,每股料液的进料流量应为多少?(过程按等温、恒容考虑)
l.min)],k
2.
1.7[L/(mo
l.min)]。若反应在一全混釜式反应器中进行,其中物料容量为100L。二股进料流同时等流量导入反应器,其中一股含A物料
3.0[mol/L],另一股含B物料2.0[mol/L],求当B的转化率为80%时,每股料液的进料流量应为多少?(过程按等温、恒容考虑)
题目解答
答案
解:因为是等温、恒容过程,当B的转化率为80%时,在反应器中和反应器的出口流中各组分的浓度应为:
在反应开始时各组分的浓度为:CA0=1.5[mol/L];CB0=1.0[mol/L];CP0=0;CR0=0;
∴CB=CB0(1-xB)=1.0(1-0.8)=0.2[mol/L]
CA=CA0-CB0xB=1.5-1.0×0.8=0.7[mol/L]
Cp= CB0xB=1.0×0.8=0.8[mol/L];CR= CB0xB=1.0×0.8=0.8[mol/L]
对可逆反应有:(-rA)=(-rB)=k1CACB-k2CPCR
=8×0.7×0.2-1.7×0.8×0.8=0.04[mol/(L.min)]
对于CSTR:
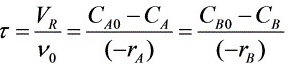
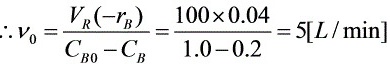
所以,两股进料流中每一股流量应为2.5(L/min)。
答:略。
解析
考查要点:本题主要考查连续搅拌釜式反应器(CSTR)中可逆反应的物料衡算与速率方程的应用,涉及转化率、浓度变化及流量计算。
解题核心思路:
- 确定初始浓度:根据两股等流量进料,计算混合后的初始浓度。
- 转化率与浓度关系:根据B的转化率,推导各组分的平衡浓度。
- 速率方程:建立正、逆反应速率的差值,计算净反应速率。
- 停留时间方程:利用CSTR的停留时间公式,结合反应速率和浓度变化,求解总进料流量,最终得到每股流量。
破题关键点:
- 正确写出各组分的平衡浓度,需明确反应式中物质的转化关系。
- 准确代入速率方程,注意正、逆反应速率的叠加。
- 区分总流量与单股流量,避免混淆导致计算错误。
1. 初始浓度计算
两股进料流量相等,混合后初始浓度为:
- A的初始浓度:$C_{A0} = \frac{3.0}{2} = 1.5 \, \text{mol/L}$
- B的初始浓度:$C_{B0} = \frac{2.0}{2} = 1.0 \, \text{mol/L}$
2. 平衡浓度计算
B的转化率为$80\%$,则:
- B的平衡浓度:$C_B = C_{B0}(1 - x_B) = 1.0 \times (1 - 0.8) = 0.2 \, \text{mol/L}$
- A的平衡浓度:$C_A = C_{A0} - C_{B0}x_B = 1.5 - 1.0 \times 0.8 = 0.7 \, \text{mol/L}$
- 产物P、R的浓度:$C_P = C_R = C_{B0}x_B = 1.0 \times 0.8 = 0.8 \, \text{mol/L}$
3. 净反应速率计算
速率方程为:
$(-r_A) = k_1 C_A C_B - k_2 C_P C_R$
代入数据:
$(-r_A) = 8 \times 0.7 \times 0.2 - 1.7 \times 0.8 \times 0.8 = 1.12 - 1.088 = 0.032 \, \text{mol/(L·min)}$
4. 停留时间方程
停留时间$t$满足:
$t = \frac{V_R}{V_0} = \frac{C_{A0} - C_A}{-r_A}$
代入数据:
$t = \frac{1.5 - 0.7}{0.032} = \frac{0.8}{0.032} = 25 \, \text{min}$
总进料流量:
$V_0 = \frac{V_R}{t} = \frac{100}{25} = 4 \, \text{L/min}$
每股流量:
$Q = \frac{V_0}{2} = \frac{4}{2} = 2 \, \text{L/min}$