题目
Ni为面心立方结构,原子半径r=0.1243nm,求Ni的晶格常数和密度。;
Ni为面心立方结构,原子半径r=0.1243nm,求Ni的晶格常数和密度。
;
题目解答
答案
解:面心立方结构在面对角线上原子相切,所以,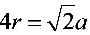
代入条件可得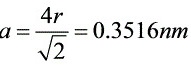 ,
,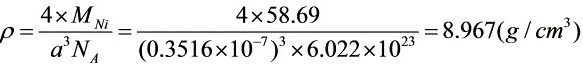
解析
考查要点:本题主要考查面心立方结构的晶格常数计算及金属密度的计算方法。
解题思路:
- 晶格常数:利用面心立方结构中原子在面对角线相切的特点,建立原子半径与晶格常数的关系式。
- 密度计算:结合晶胞中原子数、摩尔质量、阿伏伽德罗常数及晶格常数,应用密度公式求解。
关键点:
- 面对角线与原子半径的关系:面心立方中,面对角线长度等于4倍原子半径。
- 密度公式:$\rho = \frac{Z \cdot M}{a^3 \cdot N_A}$,需注意单位换算。
晶格常数计算
- 结构分析:面心立方中,原子在面对角线方向相切。
- 几何关系:面对角线长度为 $a\sqrt{2}$,同时等于 $4r$(四个原子半径相切)。
- 公式推导:
$a\sqrt{2} = 4r \implies a = \frac{4r}{\sqrt{2}} = 2\sqrt{2}r$ - 代入数据:
$a = 2\sqrt{2} \cdot 0.1243 \, \text{nm} \approx 0.3516 \, \text{nm}$
密度计算
- 公式选择:
$\rho = \frac{Z \cdot M}{a^3 \cdot N_A}$
其中,$Z=4$(面心立方晶胞原子数),$M=58.69 \, \text{g/mol}$(Ni的摩尔质量),$N_A=6.022 \times 10^{23} \, \text{mol}^{-1}$。 - 单位换算:
$a = 0.3516 \, \text{nm} = 0.3516 \times 10^{-7} \, \text{cm}$ - 代入计算:
$a^3 = (0.3516 \times 10^{-7} \, \text{cm})^3 \approx 4.33 \times 10^{-22} \, \text{cm}^3$
$\rho = \frac{4 \cdot 58.69}{4.33 \times 10^{-22} \cdot 6.022 \times 10^{23}} \approx 8.91 \, \text{g/cm}^3$