题目
(2012某某)盐水选种是我国古代劳动人民发明的一种巧妙的挑选种子的方法。农业生产上常用质量分数为15%~20%的氯化钠溶液来选种。(1)要配制150 kg 16%的氯化钠溶液,计算应称取氯化钠的质量。(2)选种进行一段时间后,农技员估计溶液和溶质质量分数都有所减少,他取出50 g氯化钠溶液,加入过量AgNO3溶液,得到沉淀14.35 g,计算氯化钠溶液中溶质的质量分数。(3)若此时氯化钠溶液的质量只剩下100 kg,要使溶液质量和溶质质量分数都恢复到(1)中的状态,计算需要加入的氯化钠和水的质量。好题精练1. (2017某某改编)现有碳酸钠和氯化钠的固体混合物12.6 g,其中含氧元素4.8 g,将该混合物加入到一定质量的稀盐酸中,恰好完全反应,得到137 g氯化钠溶液。计算:(1)氯化钠中钠元素与氯元素的质量比为______。(2)原固体混合物中碳酸钠的质量分数(结果保留至0.1%)。(3)所用稀盐酸中溶质的质量分数(结果保留至0.1%)。2. 味精是常用的调味品,它的鲜味来自于主要成分“谷氨酸钠”(化学式C5H8NO4Na,易溶于水,与AgNO3不反应)。味精中还含有NaCl(其他成分不考虑)。请回答下列问题。(1)谷氨酸钠中氢元素与氧元素的质量比是____________。(2)某兴趣小组为测定某品牌味精中NaCl的质量分数,进行了如下实验:将5 g味精溶于足量水,向其中滴加过量的AgNO3溶液。充分反应后,将沉淀进行__________、洗涤、干燥、称量,得到2.87 g沉淀。(3)请计算该品牌味精中NaCl的质量分数。3. (2017某某二外模拟)某补钙品(有效成分为碳酸钙,其它成分不含钙元素)的说明中标明含钙量为30%。琳琳同学为了检验该产品,取10 g补钙品放入100 g稀盐酸中,HCl与补钙品的有效成分刚好完全反应(其它成分不与盐酸反应)。反应后剩余固体和液体的总质量比反应前减少了2.2 g。求:(1)补钙品中实际含钙的质量分数是多少?(2)所用稀盐酸中溶质的质量分数是多少?4. 乙炔(C2H2)是生产聚氯乙烯的重要原料。用电石(主要成分为CaC2)与水反应可制取乙炔,最终还可得到电石渣。某电石渣中含氢氧化钙92.5%,其余为杂质,此电石渣可用于处理电镀厂排出的酸性废水。(1)乙炔中碳、氢元素的质量比为________。(2)100 kg上述电石渣中氢氧化钙的质量为________kg。(3)用上述电石渣处理含硫酸196 kg的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),求至少需要电石渣的质量(写出计算过程及结果)。5. 为测量某黄铜样品中锌的含量,某同学称取20 g黄铜(铜和锌的合金)样品于烧杯中,向其中加入稀硫酸至不再产生气泡为止,共消耗100 g溶质质量分数为9.8%的稀硫酸。请计算:(1)该黄铜样品中锌的质量。(2)反应后所得溶液的溶质质量分数(计算结果保留到0.1%)。(3)若要用98%的浓硫酸来配制100 g溶质质量分数为9.8%的稀硫酸需加水的质量。6. 某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取5 g样品,加入27 g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH。当pH=7时,刚好用去10%的稀盐酸36.5 g。试计算:(1)将100 g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需加水的质量。(2)样品中氢氧化钠的质量分数。(3)反应后所得溶液中溶质的质量分数。7. 氯碱工业是指用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,电解饱和NaCl溶液的化学方程式:2NaCl+2H2O Cl2↑+H2↑+2NaOH请计算:(1)烧碱中钠、氧、氢三种元素的质量比为______。(2)用这种方法制备40 t烧碱,需要食盐的质量。(3)若用25%的食盐溶液按照上述方法电解并制取40 t烧碱,完全电解后所得溶液的质量分数。(假设生成的烧碱全溶,计算时若除不尽保留0.1%)8.某校化学兴趣小组在参加社会实践活动时,环保组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保组的同学进行了以下实验。取废水300 g,向其中加入溶质质量分数为20%的氢氧化钠溶液,当加入80 g氢氧化钠溶液时恰好完全反应,生成沉淀的质量为4.9 g。请分析计算:(1)300 g该废水中硫酸铜的质量。(2)该废水中硫酸的溶质质量分数(计算结果精确到0.1%)。9. 振衡中学校办工厂利用熟石灰与纯碱反应生产工业烧碱,学校化学兴趣小组到校办工厂检验刚生产出的一批产品的纯度(氢氧化钠的质量分数)。检验时称取样品20.00 g,溶于100.00 g水中,向其中逐滴加入氢氧化钡[Ba(OH)2]溶液,当恰好不再产生沉淀(BaCO3)时,用去溶质的质量分数为10.0%的氢氧化钡溶液8.55 g。试求:(1)反应中生成的碳酸钡的质量(保留2位小数)。(2)该批产品中氢氧化钠的质量分数(精确到0.1%)。(3)反应后所得溶液中氢氧化钠的质量分数(精确到0.1%)
(2012某某)盐水选种是我国古代劳动人民发明的一种巧妙的挑选种子的方法。农业生产上常用质量分数为15%~20%的氯化钠溶液来选种。
(1)要配制150 kg 16%的氯化钠溶液,计算应称取氯化钠的质量。
(2)选种进行一段时间后,农技员估计溶液和溶质质量分数都有所减少,他取出50 g氯化钠溶液,加入过量AgNO3溶液,得到沉淀14.35 g,计算氯化钠溶液中溶质的质量分数。
(3)若此时氯化钠溶液的质量只剩下100 kg,要使溶液质量和溶质质量分数都恢复到(1)中的状态,计算需要加入的氯化钠和水的质量。
好题精练
1. (2017某某改编)现有碳酸钠和氯化钠的固体混合物12.6 g,其中含氧元素4.8 g,将该混合物加入到一定质量的稀盐酸中,恰好完全反应,得到137 g氯化钠溶液。计算:
(1)氯化钠中钠元素与氯元素的质量比为______。
(2)原固体混合物中碳酸钠的质量分数(结果保留至0.1%)。
(3)所用稀盐酸中溶质的质量分数(结果保留至0.1%)。
2. 味精是常用的调味品,它的鲜味来自于主要成分“谷氨酸钠”(化学式C5H8NO4Na,易溶于水,与AgNO3不反应)。味精中还含有NaCl(其他成分不考虑)。请回答下列问题。
(1)谷氨酸钠中氢元素与氧元素的质量比是____________。
(2)某兴趣小组为测定某品牌味精中NaCl的质量分数,进行了如下实验:将5 g味精溶于足量水,向其中滴加过量的AgNO3溶液。充分反应后,将沉淀进行__________、洗涤、干燥、称量,得到2.87 g沉淀。
(3)请计算该品牌味精中NaCl的质量分数。
3. (2017某某二外模拟)某补钙品(有效成分为碳酸钙,其它成分不含钙元素)的说明中标明含钙量为30%。琳琳同学为了检验该产品,取10 g补钙品放入100 g稀盐酸中,HCl与补钙品的有效成分刚好完全反应(其它成分不与盐酸反应)。反应后剩余固体和液体的总质量比反应前减少了2.2 g。求:
(1)补钙品中实际含钙的质量分数是多少?
(2)所用稀盐酸中溶质的质量分数是多少?
4. 乙炔(C2H2)是生产聚氯乙烯的重要原料。用电石(主要成分为CaC2)与水反应可制取乙炔,最终还可得到电石渣。某电石渣中含氢氧化钙92.5%,其余为杂质,此电石渣可用于处理电镀厂排出的酸性废水。
(1)乙炔中碳、氢元素的质量比为________。
(2)100 kg上述电石渣中氢氧化钙的质量为________kg。
(3)用上述电石渣处理含硫酸196 kg的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),求至少需要电石渣的质量(写出计算过程及结果)。
5. 为测量某黄铜样品中锌的含量,某同学称取20 g黄铜(铜和锌的合金)样品于烧杯中,向其中加入稀硫酸至不再产生气泡为止,共消耗100 g溶质质量分数为9.8%的稀硫酸。请计算:
(1)该黄铜样品中锌的质量。
(2)反应后所得溶液的溶质质量分数(计算结果保留到0.1%)。
(3)若要用98%的浓硫酸来配制100 g溶质质量分数为9.8%的稀硫酸需加水的质量。
6. 某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取5 g样品,加入27 g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH。当pH=7时,刚好用去10%的稀盐酸36.5 g。试计算:
(1)将100 g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需加水的质量。
(2)样品中氢氧化钠的质量分数。
(3)反应后所得溶液中溶质的质量分数。
7. 氯碱工业是指用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,电解饱和NaCl溶液的化学方程式:
2NaCl+2H2O Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH请计算:
(1)烧碱中钠、氧、氢三种元素的质量比为______。
(2)用这种方法制备40 t烧碱,需要食盐的质量。
(3)若用25%的食盐溶液按照上述方法电解并制取40 t烧碱,完全电解后所得溶液的质量分数。(假设生成的烧碱全溶,计算时若除不尽保留0.1%)
8.某校化学兴趣小组在参加社会实践活动时,环保组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保组的同学进行了以下实验。取废水300 g,向其中加入溶质质量分数为20%的氢氧化钠溶液,当加入80 g氢氧化钠溶液时恰好完全反应,生成沉淀的质量为4.9 g。
请分析计算:
(1)300 g该废水中硫酸铜的质量。
(2)该废水中硫酸的溶质质量分数(计算结果精确到0.1%)。
9. 振衡中学校办工厂利用熟石灰与纯碱反应生产工业烧碱,学校化学兴趣小组到校办工厂检验刚生产出的一批产品的纯度(氢氧化钠的质量分数)。检验时称取样品20.00 g,溶于100.00 g水中,向其中逐滴加入氢氧化钡[Ba(OH)2]溶液,当恰好不再产生沉淀(BaCO3)时,用去溶质的质量分数为10.0%的氢氧化钡溶液8.55 g。
试求:
(1)反应中生成的碳酸钡的质量(保留2位小数)。
(2)该批产品中氢氧化钠的质量分数(精确到0.1%)。
(3)反应后所得溶液中氢氧化钠的质量分数(精确到0.1%)
题目解答
答案
(1)150 kg×16%=24 kg
(2)解:设溶液中氯化钠的质量为x
AgNO3+NaCl=== AgCl↓+NaNO3
x 14.35 g
 =
=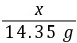 x=5.85 g
x=5.85 g氯化钠溶液中溶质的质量分数: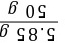 ×100%=11.7%
×100%=11.7%
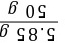 ×100%=11.7%
×100%=11.7%(3)需要加入氯化钠的质量:24 kg-100 kg×11.7%=12.3 kg
需要加入水的质量:150 kg-100 kg-12.3 kg=37.7 kg
答:(1)应称取氯化钠的质量为5.85 g;(2)氯化钠溶液中溶质质量分数为11.7%;(3)需加入氯化钠12.3 kg,需加入水质量为37.7 kg。
好题精练
1. (1)23∶35.5(或46∶71)
解:(2)由于碳酸钠和氯化钠的混合物中只有碳酸钠含有氧元素,且氧元素质量为4.8 g
则碳酸钠的质量为4.8 g÷(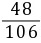 ×100%)=10.6 g
×100%)=10.6 g
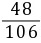 ×100%)=10.6 g
×100%)=10.6 g原混合物中碳酸钠的质量分数为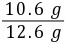 ×100%≈84.1%。
×100%≈84.1%。
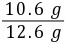 ×100%≈84.1%。
×100%≈84.1%。(3)设消耗稀盐酸的质量为x,生成二氧化碳的质量为y
Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
106 73 44
10.6 g xy
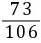 =
=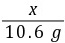 x=7.3 g
x=7.3 g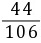 =
=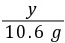 y=4.4 g
y=4.4 g稀盐酸的质量:137 g+4.4 g-12.6 g=128.8 g
稀盐酸中溶质的质量分数: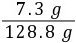 ×100%≈5.7%
×100%≈5.7%
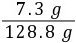 ×100%≈5.7%
×100%≈5.7%答:(2)原混合物中碳酸钠的质量分数约为84.1%;(2)稀盐酸中溶质的质量分数约为5.7%。
2.(1)1∶8(2)过滤
(3)解:设5 g该品牌味精中含NaCl的质量为x
NaCl+AgNO3=== AgCl↓+NaNO3
x2.87 g
 =
=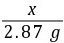 x=1.17 g
x=1.17 g5 g该品牌味精中NaCl的质量分数为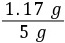 ×100%=23.4%
×100%=23.4%
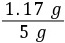 ×100%=23.4%
×100%=23.4%答:(3)该品牌味精中NaCl的质量分数为23.4%。
3.解:设补钙品中CaCO3的质量为x,稀盐酸中HCl的质量为y
CaCO3+2HCl=== CaCl2+H2O+CO2↑
1007344
xy2.2 g
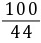 =
=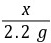 x=5 g
x=5 g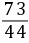 =
=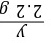 y=3.65 g
y=3.65 g(1)CaCO3中钙元素的质量分数为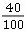 ×100%=40%
×100%=40%
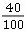 ×100%=40%
×100%=40%补钙品中实际含钙的质量分数为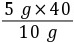 ×100%=20%
×100%=20%
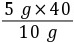 ×100%=20%
×100%=20%(2)盐酸中溶质的质量分数为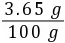 ×100%=3.65%
×100%=3.65%
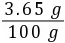 ×100%=3.65%
×100%=3.65%答:(1)补钙品中实际含钙的质量分数是20%;(2)所用稀盐酸中溶质的质量分数是3.65%。
4. (1)12∶1
(3)解:设需要电石渣中Ca(OH)2的质量为x
Ca(OH)2+H2SO4=== CaSO4+2H2O
7498
x196 kg
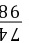 =
=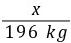 x=148 kg
x=148 kg需要电石渣的质量为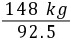 =160 kg
=160 kg
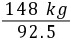 =160 kg
=160 kg答:(3)需要电石渣160 kg。
5. 解:(1)设黄铜样品中锌的质量为x,生成硫酸锌的质量为y,生成氢气的质量为z
稀硫酸中硫酸质量:100 g×9.8%=9.8 g,
Zn+H2SO4=== ZnSO4+H2↑
65981612
x9.8 g yz
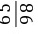 =
=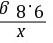 x=6.5 g
x=6.5 g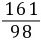 =
=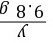 y=16.1 g
y=16.1 g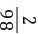 =
=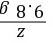 z=0.2 g
z=0.2 g(2)反应后所得溶液的溶质质量分数为
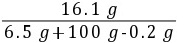 ×100%≈15.1%
×100%≈15.1%(3)需要浓硫酸的质量为: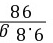 =10 g,
=10 g,
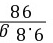 =10 g,
=10 g,则需要水的质量为:100 g-10 g=90 g
答:(1)该黄铜样品中锌的质量是6.5 g;(2)反应后所得溶液的溶质质量分数约为15.1%;(3)需要加水的质量是90 g。
6. 解:(1)稀释前后溶质的质量不变,设需加水的质量为x
则有100 g×38%=(100 g+x)×10%x=280 g
(2)设氢氧化钠的质量为y,生成氯化钠的质量为z
NaOH+HCl === NaCl+H2O
40
y 36.5 g×10% z
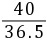 =
=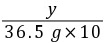 y=4 g
y=4 g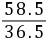 =
=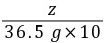 z=5.85 g
z=5.85 g样品中氢氧化钠的质量分数为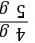 ×100%=80%
×100%=80%
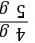 ×100%=80%
×100%=80%(3)反应后所得溶液中溶质的质量分数为
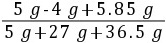 ×100%=10%
×100%=10%答:(1)需加水的质量为280 g;(2)样品中氢氧化钠的质量分数为80%;(3)反应后所得溶液中溶质的质量分数为10%。
7. (1)23∶16∶1
解:(2)设制备40 t烧碱,需要食盐的质量为x
2NaCl+2H2O Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH11780
x40 t
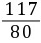 =
=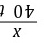 x=58.5 t
x=58.5 t(3)25%的食盐溶液的质量为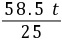 =234 t
=234 t
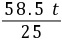 =234 t
=234 t设制备40 t烧碱,同时生成Cl2、H2的质量分别为y、z
2NaCl+2H2O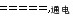 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH71280
yz40 t
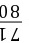 =
=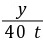 y=35.5 t
y=35.5 t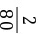 =
=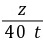 z=1 t
z=1 t故电解并制取40 t烧碱,完全电解后所得溶液的质量分数为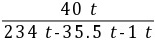 ×100%≈20.3%
×100%≈20.3%
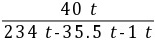 ×100%≈20.3%
×100%≈20.3%答:(2)制备40 t烧碱,需要食盐的质量为58.5 t;(3)完全电解后所得溶液的质量分数约为20.3%。
8. (1)解:设300 g废水中CuSO4的质量为x,与CuSO4反应的NaOH溶液的质量为y
CuSO4+2NaOH=== Cu(OH)2↓+Na2SO4
1608098
xy×20%4.9 g
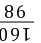 =
=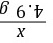 x=8 g
x=8 g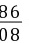 =
=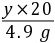 y=20 g
y=20 g(2)设300 g该废水中H2SO4的质量为z
H2SO4+2NaOH=== Na2SO4+2H2O
9880
z(80 g-20 g)×20%
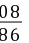 =
=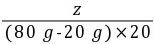 z=14.7 g
z=14.7 g废水中硫酸的质量分数为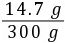 ×100%=4.9%
×100%=4.9%
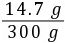 ×100%=4.9%
×100%=4.9%答:(1)300 g该废水中硫酸铜的质量为8 g;(2)该废水中硫酸的溶质质量分数为4.9%。
[解析](1)根据氢氧化铜沉淀的质量以及硫酸铜与氢氧化钠反应的化学方程式可求出300g废水中硫酸铜的质量;(2)根据氢氧化铜沉淀的质量以及硫酸铜与氢氧化钠反应的化学方程式可求出与硫酸铜反应所消耗氢氧化钠的质量,总共消耗氢氧化钠的质量减去硫酸铜消耗氢氧化钠的质量即为硫酸消耗氢氧化钠的质量,然后再根据硫酸与氢氧化钠反应的化学方程式可求出废水中硫酸的质量,进而可计算出300 g废水中硫酸的质量分数。
9. (1)解:设生成的BaCO3的质量为x,样品中含有的碳酸钠质量为y,生成的氢氧化钠的质量为z
Na2CO3+Ba(OH)2=== BaCO3↓+2NaOH
10617119780
y8.55 g×10.0%xz
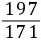 =
=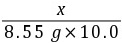 x≈0.99 g
x≈0.99 g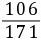 =
=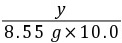 y=0.53 g
y=0.53 g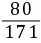 =
=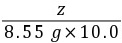 y=0.40 g
y=0.40 g则样品中氢氧化钠的质量为20.00 g-0.53 g=19.47 g
(2)产品中氢氧化钠的质量分数为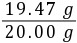 ×100%≈97.4%
×100%≈97.4%
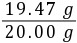 ×100%≈97.4%
×100%≈97.4%(3)反应后所得溶液中氢氧化钠的质量为19.47 g+0.40 g=19.87 g
根据质量守恒定律,反应后所得溶液的质量为20.00 g+100.00 g+8.55 g-0.99 g=127.56 g
反应后所得溶液中氢氧化钠的质量分数为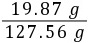 ×100%≈15.6%
×100%≈15.6%
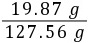 ×100%≈15.6%
×100%≈15.6%答:(1)反应中生成的碳酸钡的质量约为0.99 g;(2)该批产品中氢氧化钠的质量分数约为97.4%;(3)反应后所得溶液中氢氧化钠的质量分数约为15.6%