题目
对于乙酸乙酯在碱性水溶液中的水解反应,溶液的总体积为150mL,碱和乙酸乙酯的初试浓度均为,测得其反应速率常数为;若保持溶液的总体积仍为150mL,其中含50mL乙醇,碱和乙酸乙酯的初试浓度仍均为,此时测得的反应速率常数为。则有A. = B. < C. > D. 反应系统不稳定,无法测得
对于乙酸乙酯在碱性水溶液中的水解反应,溶液的总体积为150mL,碱和乙酸乙酯的初试浓度均为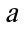 ,测得其反应速率常数为
,测得其反应速率常数为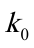 ;若保持溶液的总体积仍为150mL,其中含50mL乙醇,碱和乙酸乙酯的初试浓度仍均为
;若保持溶液的总体积仍为150mL,其中含50mL乙醇,碱和乙酸乙酯的初试浓度仍均为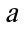 ,此时测得的反应速率常数为
,此时测得的反应速率常数为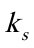 。则有
。则有
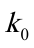 =
= 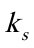
B.
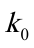 <
<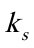
C.
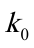 >
>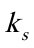
D. 反应系统不稳定,无法测得
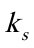
题目解答
答案
C. °y>
解析
本题考查溶剂对反应速率的影响,核心在于理解不同溶剂环境下反应速率常数的变化规律。关键点在于:
- 乙酸乙酯的碱性水解反应机理涉及离子中间体的形成,极性溶剂(如水)能稳定中间体,降低活化能,加快反应;
- 乙醇的介电常数低于水,作为溶剂时极性较弱,可能降低中间体的稳定性,从而提高活化能,减缓反应速率;
- 两种情况下反应物浓度相同,但溶剂组成不同,需通过溶剂性质判断速率常数的相对大小。
反应机理与溶剂作用
乙酸乙酯在碱性水溶液中的水解反应为:
$\text{CH}_3\text{COOC}_2\text{H}_5 + \text{OH}^- \rightarrow \text{CH}_3\text{COO}^- + \text{C}_2\text{H}_5\text{OH}$
反应过程中,氢氧根离子通过亲核攻击乙酸乙酯,形成中间四面体离子。此时,极性溶剂(如水)通过静电作用稳定中间体,降低活化能,加快反应速率。
溶剂变化的影响
- 第一种情况(无乙醇):溶剂为纯水,极性强,中间体稳定,活化能较低,速率常数为$k_1$;
- 第二种情况(含乙醇):溶剂为水与乙醇混合物,乙醇的介电常数(24.3)低于水(78.5),极性减弱,中间体稳定性降低,活化能升高,速率常数为$k_2$;
- 结论:$k_1 > k_2$,即选项C正确。